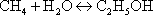Задание 13 вар 1 Получение этанола методом прямой гидратацией эт |
||
| Свежий этилен и рециркулируюший газ, сжатые до 8-10 МПа, смешивают с водой. Смесь подогревают до 200°С за счет горячих реакционных газов. Далее пары перегревают до 290°С в трубчатой печи и подают в гидрататор, где в присутствии гетерогенного ката¬лизатора | ||
|
| ||
| ( ОХТ ) |
||
|
pуб 400
|
||
|
Получение этанола методом прямой гидратацией этилена Исходные данные: Пропускная способность по этилену, тыс. м /сут 50 Состав этилена, % об.: этилен 95 этан 5 Мольное соотношение – Водяной пар:CH4 0,7:1 Условия реакции: температура, °С 290 давление,атм 80 Работа выполнена по следующему плану 1. Составлена технологическая, функциональная и операторная схему производства в виде эскизов, а также схема реатора 2. Составилен материальный баланс процесса (пояснения к расчету и таблица материального баланса приход/расход) 3. Рассчитаны технико-экономические параметры процесса а) производительность и пропускную способность б) выход продукта на поданное сырье. в) теоретический и фактический расходные коэффциенты по сырью. г) конверсия и селективность Степень достижения равновесия 0,9aр Температурная зависимость lgKp = 2100/T - 6,195 Потери этанола, %мас. 1
Файл помощи оформления заказа и порядок (инструкция) его получения Краткая теория процесса
В настоящее время в промышленности используют два основных процесса синтеза спиртов из низших олефинов: сернокислотную жидкофазную и гетеро-каталитическую (прямую) гидратацию. В обоих процессах в реакции участвуют промежуточные карбкатионы (продукт электрофильного присоединения протона к олефину). Такое при-соединение к -олефину всегда протекает по правилу Марковникова и поэтому в итоге образуются вторичные и третичные спирты (исключение – этанол, у которого нет изомерных вторичных и третичных спиртов). Сила протонных кислот, т.е. способность протонировать основания, возрастает с увеличением их концентрации. В разбавленных растворах кислот (для Н2SО4 – ниже 80 %) протонирующим агентом является ион гидроксония Н3+О. В растворах с высокой концентрацией серной кислоты протонирующим агентом выступает сама кислота в недиссоциированной форме (Н2SО4) или катион, получающийся в результате автопротолиза |
||
|
|
||
Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи
Задание 129 вар 1 Производство малеинового ангидрида окислением Задание 13 вар 3 Расчет материального баланса получения этанола