Задание 131 вар 2 Производство хлоропрена |
||
| Пропускная способность по С2Н2, 8 т/час Концентрация С2Н2, 98 % об. (примесь – СН4) Концентрация НСl, 96% об. (примесь – Н2) Выход хлоропрена на поданный С2Н2, 82% Потери винилацетилена, 1,5 % мас. Выход дихлорида на поданный С2Н2, 2% Выход тримера | ||
|
| ||
| ( ОХТ ) |
||
|
pуб 300
|
||
|
66 Производство хлоропрена
На первой стадии ацетилен при температуре 80 °С пропускают в аппарате с мешалкой через слой катализатора. Образуются вини-лацетилен и побочный пример ацетилена:
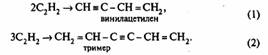 Газообразную реакционную смесь разделяют путем ступенчатого охлаждения. Несконденсировавшийся ацетилен возвращают в процесс. На второй стадии газообразные винилацетилен и хлористый водород взаимодействуют в аппарате, заполненном раствором однохлористой меди при температуре 60 °С.
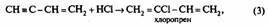 Продукты непрерывно отгоняют из реактора. Пары хлоропрена и дихлорида конденсируют и подвергают разделению, а не вошедший в реакцию газообразный винилацетилен возвращают в процесс.
Пропускная способность по С2Н2, 8 т/час Работа выполнена по следующему плану в формете doc без схем 1. Составлена технологическая, функциональная и операторная схему производства в виде эскизов, а также схема реатора 2. Составилен материальный баланс процесса (пояснения к расчету и таблица материального баланса приход/расход) 3. Рассчитаны технико-экономические параметры процесса а) производительность и пропускную способность б) выход продукта на поданное сырье. в) теоретический и фактический расходные коэффциенты по сырью. г) конверсия и селективность Файл помощи оформления заказа и порядок (инструкция) его получения Краткая теория процесса
Ранее было показано, что наибольшее применение из хлорорганичес-ких продуктов имеют хлорпроизводные метана и этана. Их получают, как правило, прямым хлорированием соответствующих углеводородов.
При хлорировании парафинов атомы хлора замещают в них атомы водорода, которые отщепляются с образованием хлористого водорода НСl. Аналогичные процессы протекают при взаимодействии парафинов с другими галогенами. При этом могут получаться моно-, ди- и полигалогенпроизводные. Общую схему таких процессов можно изобразить следующим образом [14]:
RH +Hal2 = RНal + HНal,
где Hal – это F2 , Cl2 , Br2.
Здесь следует отметить, что наряду с процессами нефтепереработки (крекинг, пиролиз, риформинг, алкилирование, изомеризация) и прямым окислением, галогенирование является одной из немногих технологий, использующих алканы в качестве исходного сырья. Реакции хлорирования и бромирования менее вероятны, если замещаемый атом водорода расположен у ненасыщенного атома углерода, непосредственно у двойной связи или в ароматическом кольце. Замещение водорода на фтор является одной из наиболее экзотермических реакций в природе. Так расчетная теплота реакции фторирования гептана |
||
|
|
||
Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи
Задание 13. В отстойник подается суспензияЗадание 135 вар 1 Производство этаноламинов из окиси этилена

