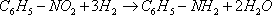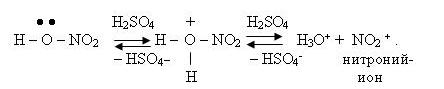Задание 1 вар 3 Производство нитробензола |
||
| Нитробензол испаряют его пары смешивают при температуре 250°С. Водород смешивают с парами нитробензола и подают под распределительную решетку реактора с кипящим слоем катализатора при 270°С и давлении 0,15 МПа происходит образование анилина: Тепловой э | ||
|
| ||
| ( ОХТ ) |
||
|
pуб 400
|
||
|
Исходные данные: Нагрузка установки по нитробензолу, т/сут 30 Состав нитробензола тех, % мас.: нитробензол 97,5 бензол 2,5 Конверсия нитробензола,% 98 Мольное соотношение “нитробензол : Н ” 1:4 Содеожание Н в сырье ( примесь ), % об. 96 Потери нитробензола, %мас. От поданного 1,3
Работа выполнена по следующему плану 1. Составлена технологическая, функциональная и операторная схему производства в виде эскизов, а также схема реатора 2. Составилен материальный баланс процесса (пояснения к расчету и таблица материального баланса приход/расход) 3. Рассчитаны технико-экономические параметры процесса а) производительность и пропускную способность б) выход продукта на поданное сырье. в) теоретический и фактический расходные коэффциенты по сырью. г) конверсия и селективность Файл помощи оформления заказа и порядок (инструкция) его получения Краткая теория процесса Нитрование бензола проводят с целью получения нитробензола – полупродукта для синтеза красителей, лекарств, парфюмерных изделий и т. д. Из нитробензола получают анилин, бензидин, м-нитроаланин, м-фенилендиамин, п-аминосалициловую кислоту и др. Кроме того, нитробензол является хорошим растворителем многих органических соединений.
Нитрование проводят при 65–70 оС нитрующей смесью, содержащей серную и азотную кислоту (концентрированные), а также воду. Соотношение этих компонентов определяется фактором нитрующей активности (Ф.Н.А.), который рассчитывают по формуле [2]: Ф. Н. А. = Sc, (1) где Sс – доля серной кислоты в нитрующей смеси, % масс.; Nc – доля азотной кислоты в нитрующей смеси, % масс. Обычно нитрующая смесь имеет состав, % масс.: НNO3 34, H2SO4 54,5, H2O 11,5, что соответствует величине Ф. Н. А., равной 72. Механизм нитрования описывается несколькими реакциями. На первой стадии образуется нитроний-ион [1]:
|
||
|
|
||
Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи