Задачи по ОХТ
Решение задач по технологии полимеров Зильберман часть3
Задача ЗИБП 179. Определите содержание ингибитора в виниловом мономере, если в присутствии 0,005 моль*л-1 инициатора (kr=2,2*106 с-1, f=0,9), распадающегося по схеме I=2R, продолжительность индукционного периода составляла 17,5 мин. Известно, что одна молекула ингибитора обрывает одну кинетическую цепь, а эффективность инициирования практически не изменяется в ходе реакции.
Скачать решение задачи ЗИБП 179 (Задачник Зильберман) цена 50р
Задача ЗИБП 180. При скорости инициирования 2,3*10-8 моль*л-1*с-1 начальная скорость полимеризации 1 М раствора стирола была 0,41*10-5 моль*л-1*с-1. Сколько нитробензола (Сz=0,326) следует ввести в реакционную смесь для понижения скорости полимеризации до 0,19*10-5 моль-1*с-1? Вычислите длину кинетической цепи в отсутствие и в присутствии ингибитора.
Скачать решение задачи ЗИБП 180 (Задачник Зильберман) цена 50р
Задача ЗИБП 181. Радикальная полимеризация 1 М раствора винилового мономера проводится с начальной скоростью 0,75*10-5 моль*л-1*с-1, kр=145 л*моль-1*с-1, kо=2,9*107 л*моль-1*с-1. Какое количество ингибитора (Сz=0,15) необходимо для уменьшения скорости в два раза?
Скачать решение задачи ЗИБП 181 (Задачник Зильберман) цена 50р
Задача ЗИБП 182. Выведите зависимость скорости обрыва, обусловленного взаимодействием свободных радикалов с ингибитором, от скоростей инициирования, неингибированной и ингибированной полимеризации. Какова скорость обрыва за счет ингибирования (Rz) при полимеризации акрилового соединения, если Rи=8,5*10-7 моль*л-1*с-1, Rр в отсутствие и в присутствии ингибитора – 2,5*10-5 и 8,2*10-6 моль*л-1*с-1?
Скачать решение задачи ЗИБП 182 (Задачник Зильберман) цена 50р
Задача ЗИБП 183. Определите концентрацию свободных радикалов при полимеризации стирола в присутствии 0,05 моль*л-1 ингибитора, константа ингибирования которого равна 0,035, если продолжительность существования единичного радикала равна 0,006 с, константы скорости роста и обрыва составляют соответственно 163 и 7,36*107 л*моль-1*с-1, длина кинетической цепи.
Скачать решение задачи ЗИБП 183 (Задачник Зильберман) цена 50р
Задача ЗИБП 184. Полимеризация стирола ([М]=2моль*л-1) проводилась при 60 оС со скоростью 2,5*10-6 моль*л-1*с-1 отсутствие ингибитора и в присутствии 0,003, 0,01, 0,05 и 0,2 моль*л-1 ингибитора. Определите для всех пяти вариантов значения скорости инициирования, обеспечивающих одинаковую скорость полимеризации. Вычислите также соответствующие значения длин кинетической цепи и среднечисловой степени полимеризации. По полученным данным постройте график. В расчетах используйте следующие данные: kp=145 л*моль-1*с-1, kо=2,9*107 л*моль-1*с-1, kz=30 л*моль-1*с-1, Cм=0,9*10-4. Обрыв без участия ингибитора происходит путем рекомбинации, передача цепи на инициатор отсутствует, передача цепи на растворитель очень мала и ею можно пренебречь.
Скачать решение задачи ЗИБП 184 (Задачник Зильберман) цена 50р
Задача ЗИБП 185. Полимеризация винилацетата проводится в растворе, содержащем 0,01 моль*л-1 нитробензола. Зная константу ингибирования нитробензола (11,2 при 50 оС), вычислите максимально возможную степень полимеризации винилацетата. Концентрация мономера 2 моль*л-1.
Скачать решение задачи ЗИБП 185 (Задачник Зильберман) цена 50р
Задача ЗИБП 186. Гетерофазная полимеризация 2 М раствора винилового мономера (kp=4,1*103 л*моль-1*с-1) проводится в присутствии 0,05 моль*л-1 ингибитора (Cz=0,8). Обрыв основан на взаимодействии радикалов с ингибитором и на переходе радикалов в твердую фазу («замуровывание» радикалов). Вычислите эффективную константу скорости обрыва за счет перехода радикалов в твердую фазу, если скорости инициирования и полимеризации равны соответственно 8,5*10-9 и 2,0*10-7 моль*л-1*с-1. Биомолекулярным обрывом за счет взаимодействия радикалов можно пренебречь.
Скачать решение задачи ЗИБП 186 (Задачник Зильберман) цена 50р
Задача ЗИБ 187. При полимеризации в растворе винилового мономера в присутствии 1,0*10-3 М инициатора, схема распада которого I=2R, kr=6*10-5 с-1, средняя эффективность инициирования 0,8 и сильного ингибитора, одна молекула которого обрывает две кинетические цепи, индукционный период продолжался 60 мин. Сколько ингибитора содержалось в исходной смеси?
Скачать решение задачи ЗИБ 187 (Задачник Зильберман) цена 150р
Задача ЗИБ 188. Стирол содержит 0,01 % бензохинона. Вычислите, сколько требуется инициатора (kr=2*10-5 c-1), обеспечивающего начало полимеризации через 1 ч 15 мин после его введения. При распаде молекулы инициатора образуется один активный радикал. Одна молекула бензохинона обрывает рост одного макрорадикала.
Скачать решение задачи ЗИБ 188 (Задачник Зильберман) цена 150р
Задача ЗИБ 189. Для практически полного подавления полимеризации винилового мономера в 200 мл раствора, содержащего 2,2*10-2 моль*л-1 инициатора, израсходовано 0,0023 моль ингибитора. Вычислите эффективность инициирования, если инициатор и ингибитор вступают во взаимодействие в эквимольных количествах.
Скачать решение задачи ЗИБ 189 (Задачник Зильберман) цена 150р
Задача ЗИБ 192. Полимеризация винилацетата (50°С) пол действием бис-ацетилацетонатотрифторацетата марганца (III) в присутствии 0,5*10-4 моль*л-1 ингибитора (радикал Бенфильда) протекает с практически неизменной скоростью инициирования (4,02*10-7 моль*л-1*с-1). Определите длительность индукционного периода.
Скачать решение задачи ЗИБ 192 (Задачник Зильберман) цена 150р
Задача ЗИБ 193. Выведите зависимость константы скорости распада инициатора от начальных концентраций инициатора и ингибитора, эффективности инициирования и длительности индукционного периода, если инициатор распадается по схеме I=2R, а одна молекула ингибитора связывает один свободный радикал.
Скачать решение задачи ЗИБ 193 (Задачник Зильберман) цена 150р
Задача ЗИБ 194. Определите эффективность инициирования при полимеризации метилметакрилата (40 °С) под действием 1,9 *10-3 моль*л-1 бис-ацетилацетонатотрифторацетата марганца (III), если скорость инициирования практически неизменна, kr = 1,10*10-4 с-1. Полимеризация протекает с индукционным периодом 35 мин в присутствии 3*10-4 моль*л-1 ингибитора , (радикал Бенфильда).
Скачать решение задачи ЗИБ 194 (Задачник Зильберман) цена 150р
Задача ЗИБ 204. Зная, что обрыв преимущественно протекает вследствие взаимодействия свободных радикалов с ингибитором, по концентрациям мономера и ингибитора (2,0 и 0,08 моль*л-1), начальной скорости полимеризации (0,88*10-6 моль*л-1*с-1) и константе ингибирования (1,2) вычислите начальные скорость инициирования и длину кинетической цепи.
Скачать решение задачи ЗИБ 204 (Задачник Зильберман) цена 150р
Задача ЗИБ 205. Вычислите начальные скорость полимеризации и длину кинетической цепи винилового мономера в присутствии 0,01 моль*л-1 ингибитора, константа ингибирования которого равна 9,6. Скорость инициирования 9,0 *10-9 моль*л-1*с-1, концентрация мономера 8,0 моль*л-1, Известно, что обрыв цепи осуществляется главным образом за счет взаимодействия свободных радикалов с ингибитором.
Скачать решение задачи ЗИБ 205 (Задачник Зильберман) цена 150р
Задача ЗИБ 209. Полимеризация метилметакрилата в массе (20 °С) фотоинициируется дисульфидным соединением (kи=1,1*10-6с-1), являющимся также ингибитором полимеризации. Скорость полимеризации в области, в которой скорость не зависит от концентрации дисульфидного соединения, равна 1,7*10-5 моль*л-1*с-1. Оцените значение константы ингибирования.
Скачать решение задачи ЗИБ 209 (Задачник Зильберман) цена 150р
Задача ЗИБ 210. Скорости инициирования и полимеризации винилового мономера в присутствии ингибитора (0,01 моль*л-1) составляют соответственно 1,5*10-7 и 1,8*10-5 моль*л-1*с-1. На сколько следует увеличить скорость инициирования, чтобы при добавлении дополнительного количества 0,05 моль*л-1 ингибитора скорость полимеризации не изменилась, если скорость полимеризации в отсутствие ингибитора равна 3,0 *10-5 моль*л-1*с-1? Какой при этом станет длина кинетической цепи (в процентах от исходной)?
Скачать решение задачи ЗИБ 210 (Задачник Зильберман) цена 150р
Задача ЗИБ 211. Гетерофазная полимеризация 3 М раствора винилового мономера (kр=1,1*103 л*моль-1*с-1) проводится в присутствии 0,1 моль*л-1 ингибитора (Cz = 1,0). Обрыв основан на взаимодействии радикалов с ингибитором и на переходе радикалов в твердую фату («замуровывание» радикалов). Бимолекулярным обрывом за счет взаимодействия радикалов можно пренебречь. Вычислите эффективную константу скорости обрыва за счет перехода радикалов в твердую фазу, если скорости инициирования и полимеризации равны соответственно 9,0*10-9 и 1,8*10-7 моль*л-1*с-1.
Скачать решение задачи ЗИБ 211 (Задачник Зильберман) цена 150р
Задача ЗИБ 215. Радикальная полимеризация в присутствии ингибитора характеризуется следующими исходными данными: [М]=5моль*л-1, kp:ko0,5=2 л0,5*(моль*с)-0,5, Сz=0,3, Rи=2*10-9 моль*л-1*с-1. Вычислите зависимость скорости полимеризации от концентрации ингибитора в интервале от 0,001 до 0,3 моль*л-1. Полученные результаты представьте в виде таблицы и изобразите графически в логарифмических координатах, меняя [Z] следующим образом: 0,001; 0,005; 0,01; 0,03; 0,05: 0,1; 0,2; 0,3 моль*л-1.
Скачать решение задачи ЗИБ 215 (Задачник Зильберман) цена 150р
Решение задач по технологии полимеров Зильберман часть2
Задача ЗИБП 38. Вычислите в какой степени следует разбавить растворителем реакционную смесь при радикальной полимеризации, чтобы начальная скорость реакции уменьшилась на 27%. Как при этом изменится длина кинетической цепи? Допускается, что растворитель инертен.
Скачать решение задачи ЗИБП 38 (Задачник Зильберман) цена 50р
Задача ЗИБП 39. В 1 т полиметилакрилата найдено 2,5*10-5 моль осколков инициатора, расположенных на концах макромолекул. Вычислите скорость полимеризации, если скорость инициирования равна 6,25*10-9 моль*л-1*с-1. Взаимодействия макрорадикалов с инициатором и продуктами его гомолитического распада не происходит.
Скачать решение задачи ЗИБП 39 (Задачник Зильберман) цена 50р
Задача ЗИБП 40. Какова скорость радиационной полимеризации мономера с концентрацией 5,70 моль*л-1, если за 15 мин 1л раствора мономера поглощает энергию 8,85*1018 эВ, радиационный выход инициирования составляет 6,1, а kp*kо0,5=0,14л0,5(моль*с)-0,5?
Скачать решение задачи ЗИБП 40 (Задачник Зильберман) цена 50р
Задача ЗИБП 41. Определите скорость фотохимической полимеризации мономера ([М]=1,2 моль*л-1) в присутствии карбонильного соединения, если kp*ko0,5=0,02л0,5*моль-0,5*с-0,5, квантовый выход инициирования равен 0,2, е=16,5л*моль-1*см-1, толщина поглощающего слоя 0,5см. Интенсивность падающего света (λ=313нм) 32,8*10-6кДж*с-1*л-1.
Скачать решение задачи ЗИБП 41 (Задачник Зильберман) цена 50р
Задача ЗИБП 42. Определите константу скорости реакции термического инициирования и порядок реакции по мономеру при инициировании полимеризации (120 оС) стирола, если известны следующие данные: 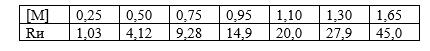
Скачать решение задачи ЗИБП 42 (Задачник Зильберман) цена 50р
Задача ЗИБП 43. Определите величину kp*ko и наблюдаемый порядок реакции по инициатору при полимеризации метакрилата натрия, если начальная концентрация мономера равна 0,65 моль*л-1, порядок реакции по мономеру – первый, константа скорости гомолитического распада персульфата калия составляет 0,96*10-4 с-1, эффективность инициирования равна 1, а скорость полимеризации в зависимости от концентрации инициатора изменяется следующим образом.
Скачать решение задачи ЗИБП 43 (Задачник Зильберман) цена 50р
Задача ЗИБП 44. Вычислите и изобразите графически температурную (45-70оС) зависимость стационарной концентрации свободных радикалов при полимеризации винилацетата в присутствии 0,01 М 2,2-азо-бис-изобутиронитрила, если f=0,68, kг и ko описываются уравнениями Аррениуса, параметры которых приведены в приложениях I и III.
Скачать решение задачи ЗИБП 44 (Задачник Зильберман) цена 50р
Задача ЗИБП 45. Какой скорости полимеризации винилового мономера соответствует продолжительность существования единичного радикала, равная 0,008с. если kо =3,6*107л*моль-1*с-1 и Rи=6,25*10-8моль*л-1*с-1?
Скачать решение задачи ЗИБП 45 (Задачник Зильберман) цена 50р
Задача ЗИБП 46. Начальные скорости полимеризации 10%-ного раствора стирола в бензоле и четыреххлористом углероде в присутствии 0,2мол.% инициаторов (от мономеров) одинаковы и равны 3,7*10-7 моль*л-1*с-1. Константы скорости роста и обрыва цепей описываются уравнениями, параметры которых приведены в приложении III. Определите среднечисловую степень полимеризации в каждом растворителе при 60 оС, если относительные константы передачи цепи на момомер, инициаторы и растворители составляют соответственно 0,8*10-4, 0,049, 0,055, 0,023*10-4, 90*10-4. Исходная масса реакционных смесей в каждом случае равна 900 г, изменением объема с повышением температуры пренебречь.
Скачать решение задачи ЗИБП 46 (Задачник Зильберман) цена 50р
Задача ЗИБП 47. Как относятся среднечисловые молекулярные массы при обрыве путем диспропорционирования 25, 50, 75% растущих радикалов, если пренебречь реакциями передачи цепи?
Скачать решение задачи ЗИБП 47 (Задачник Зильберман) цена 50р
Задача ЗИБП 48. При полимеризации винилхлорида в массе (60 оС) начальная длина кинетической цепи оказалась равной 1,0*104 и средняя степень полимеризации Х=0,97*103. Рассчитайте константу скорости передачи цепи на мономер, если допустить, что доля радикалов, образующихся путем диспропорционирования, равна 0, 0,5, 1,0, а константа роста цепи описывается уравнением, параметры которого приведены в Приложении III.
Скачать решение задачи ЗИБП 48 (Задачник Зильберман) цена 50р
Задача ЗИБП 49. Вычислите предельную начальную среднечисловую молекулярную массу поливинилхлорида, получаемого полимеризацией в массе при 30 о С в присутствии азосоединения в качестве инициатора См=6,25*10-4.
Скачать решение задачи ЗИБП 49 (Задачник Зильберман) цена 50р
Задача ЗИБП 50. Полимеризация винилового мономера, концентрация которого в растворе составляет 1,2 моль*л-1 проходит с начальной скоростью 2,2*10-6 моль*л-1*с-1 при начальной скорости инициирования 8,3*10-10 моль-1*л-1*с-1 Концентрация растворителя при температуре полимеризации 12,4 моль*л-1, концентрация инициатора 0,008 моль*л-1. Вычислите начальные скорости передачи цепи на мономер, растворитель и инициатор, если соответствующие относительные константы равны 1,05 * 10-4, 095 *10-5 и 3,3 *10-4. Сколько актов передачи цени на мономер, инициатор и растворитель приходится на 105 актов роста цепи? Вычислите начальную степень полимеризации и покажите влияние на нее каждой из реакций обрыва и передачи цепи, для чего найдите значения долей макромолекул, образующихся при помощи той или иной реакции обрыва или передачи цепи. Отношение скоростей рекомбинации и диспропорционирования равно 2:3.
Скачать решение задачи ЗИБП 50 (Задачник Зильберман) цена 50р
Задача ЗИБП 51. При полимеризации винилового мономера в массе получен полимер со среднечисловой степенью полимеризации 1600. Аналитически найдено, что в этом полимере один осколок инициатра приходится на 1800 элементарных звеньев. Зная, что См=1,3*10-4 и С1=0 вычислите отношение констант скорости рекомбинации и диспропорционирования.
Скачать решение задачи ЗИБП 51 (Задачник Зильберман) цена 50р
Задача ЗИБП 52. Для регулирования молекулярной массы при полимеризации метилметакрилата (80 °С) использовали кумол (СS=2,4*10-4). Этот регулятор заменен смесью эквимольных количеств кумола и этилбензола (CS =1,3*10-4), причем среднечисловая молекулярная масса Мп не изменилась Вычислите мольное соотношение между этой смесью и кумолом?
Скачать решение задачи ЗИБП 52 (Задачник Зильберман) цена 50р
Задача ЗИБП 53. Реакционная смесь содержащая мономер и инициатор разбавлена смесью растворителей А и В до концентрации мономера 1 моль*л -1. В каком отношении следует брать эти растворители, чтобы получить полимер с Х=2000, если радикальной полимеризацией в массе был получен полимер с начальной среднечисловой степенью полимеризации 20000. Молекулярные массы мономера и растворителей 80, 257, 110, плотности при температуре реакции – 1,20, 1,10 и 0,95 г/см3, См=1,5*10-5, СА=3*10-5, Св=8*10-5, С1=0.
Скачать решение задачи ЗИБП 53 (Задачник Зильберман) цена 50р
Задача ЗИБП 54. Выведите зависимость степеней полимеризации Хn и Хw от соотношения между скоростями передачи цепи и роста в условиях, в которых обе эти скорости соизмеримы, а скорость обрыва очень мала и ею можно пренебречь.
Скачать решение задачи ЗИБП 54 (Задачник Зильберман) цена 50р
Задача ЗИБП 55. вычислите отношения числовых долей 100-меров и 10-меров на начальной стадии процесса в продуктах радикальной полимеризации при обрыве молекулярных цепей: а) рекомбинацией, б) диспропорционированием и передачей цепи. Вероятность обрыва молекулярной цепи составляет 0,003.
Скачать решение задачи ЗИБП 55 (Задачник Зильберман) цена 50р
Задача ЗИБП 56. Выведите зависимость доли молекул, образующихся в результате обрыва диспропорционированием и передачи цепи от v, λ, См,СS, СI, [М], [S], [I]. Вычислите долю молекул, полученных путем рекомбинации свободных радикалов, если константы скорости роста и обрыва равны соответственно 6,6*103 и 3,6*107 л*моль-1*с-1, скорость инициирования 0,75*10-8 моль*л-1*с-1 30% радикалов обрывается путем диспропорционирования, относительные константы передачи цепи на мономер и растворитель 0,9*10-4 и 1,2*10-5, концентрации мономера и растворителя 2,0 и 6,4 моль*л-1. Инициатор в передаче цепи не участвует.
Скачать решение задачи ЗИБП 56 (Задачник Зильберман) цена 50р
Задача ЗИБП 57. Какой должна быть энергия активации иницирования реакции полимеризации стирола, чтобы при повышении температуры полимеризации от 80 до 90 о С длина кинетической цепи при прочих равных условиях уменьшилась не более чем на 5%? Как при этом изменится скорость полимеризации? Энергии активации роста и обрыва цепи при радикальной полимеризации стирола равны соответственно 30,5 и 7,94 кДж*моль-1.
Скачать решение задачи ЗИБП 57 (Задачник Зильберман) цена 50р
Задача ЗИБП 58. Полимеризация винилового мономера при давлении 1000 МПа протекает со скоростью, превышающей в 60 раз скорость полимеризации при атмосферном давлении и той же температуре 60 оС. Объем активированного комплекса реакций инициирования Vt и роста Vp равен соответственно 8 и -16,5 см3 *моль-1. Эти объемы, как b объем активированного комплекса для реакции обрыва Vo практически не зависят от давления. Как относятся длины кинетической цени при 1000 МПа и атмосферном давлении? Чему равен объем активированного комплекса в реакции обрыва?
Скачать решение задачи ЗИБП 58 (Задачник Зильберман) цена 50р
Задача ЗИБП 59. При фотохимической полимеризации до уста¬новления псевдостационарного состояния системы по концентрации активных центров скорость увеличения содержания активных центров была 6,2 10-7 моль*л-1*с-1. Вычислите текущую и стационарную концентрации активных центров, если интенсивность поглощения света составляет 1,2 * 10-5 моль*л-1*с-1, квантовый выход равен 0,15, константа скорости обрыва - 2,0 106 л моль-1 с-1 Какому моменту времени соответствует найденная текущая концентрация активных центров?
Скачать решение задачи ЗИБП 59 (Задачник Зильберман) цена 50р
Задача ЗИБ 68. Вычислите начальную длину кинетической цепи при полимеризации стирола, если начальная скорость полимеризации равна 6,6 *10-5 моль*л-1мин-1*мин-1, а kp/kо0,5 составляет 0,027 л0,5*(моль*с)-0,5. Содержание мономера 1,6 моль в 1,2 л раствора.
Скачать решение задачи ЗИБ 68 (Задачник Зильберман) цена 150р
Задача ЗИБ 69. Определите начальную скорость полимеризации 0,4 л стирола в присутствии 2,2'-азо-бис-изобутиронитрила, если начальная длина кинетической цепи 3000, константа распада инициатора 12*10-6 с-1, эффективность инициирования 0,65, а содержание 2,2'-азо-бис-изобутиронитрила 0,984 г
Скачать решение задачи ЗИБ 69 (Задачник Зильберман) цена 150р
Задача ЗИБ 73. Вычислите начальную длину кинетической цепи при радикальной полимеризации 1 М раствора метилметакрилата при 30 °С. если скорость полимеризации составляет 9,25*10-6 моль*л-1*с-1, а kp/ko0,5 = 0,065л0,5*(моль*с)-0,5.
Скачать решение задачи ЗИБ 73 (Задачник Зильберман) цена 150р
Задача ЗИБ 76. При полимеризации акриламида в воде и диметилсульфоксиде (40 °С) значения kpkо0,5 равны соответственно 3,3 и 0,35 л0,5 * (моль * с)-0,5. Константы скорости распада инициатора (2,2-азо-бисизобутиронитрил) в этих условиях равны 0,34*10-6 и 1,6*10-6с-1. Начальная скорость полимеризации в воде составляет 19,3 *10-4моль*л-1*с-1. Рассчитайте скорость полимеризации в диметилсульфоксиде гфи прочих равных условиях. Как следует изменить концентрацию мономера в диметилсульфоксиде, чтобы скорости полимеризации в обоих растворителях были одинаковы?
Скачать решение задачи ЗИБ 76 (Задачник Зильберман) цена 150р
Задача ЗИБ 78. Какова начальная скорость инициирования радиационной полимеризации (20 °С) акрилонитрила в массе, если kр:kо0,5 =0,70 л0,5* (моль* с)-0,5 Rр=5,0*10-4 моль*л-1*с-1? Какова при этом скорость пoглощения энергии, если эффективность радиационного инициирования 5,6?
Скачать решение задачи ЗИБ 78 (Задачник Зильберман) цена 150р
Задача ЗИБ 79. Определите начальную длину кинетической цепи при полимеризации акрилонитрила (50 °С), если стационарная концентрация растущих кинетических цепей равна 2,35 *10-8 моль*л-1, а отношение констант скорости роста и обрыва цепей равно 2,7 *10-6.
Скачать решение задачи ЗИБ 79 (Задачник Зильберман) цена 150р
Задача ЗИБ 81. Как относятся между собой длины кинетической цеци при изменении начальной скорости полимеризации в X раз путем изменения скорости инициирования и путем изменения концентрации мономера?
Скачать решение задачи ЗИБ 81 (Задачник Зильберман) цена 150р
Задача ЗИБ 84. Начальная длина кинетической цепи 2800. Определите скорость фотохимической полимеризации мономера, если квантовый выход инициирования равен 0,1, а скорость поглощения света с длиной волны 258 нм составляет 5,23 *10-2 Дж*л-1*с-1.
Скачать решение задачи ЗИБ 84 (Задачник Зильберман) цена 150р
Задача ЗИБ 85. Экспериментально найдено, что порядок реакции полимеризации по мономеру равен 1,2, а по инициатору 0,6. За счет добавления инертного растворителя начальная скорость полимеризации уменьшилась с 6,4*10-6 до 4,4*10-6 моль*л-1*с-1. На сколько (в процентах) увеличился объем реакционной смеси?
Скачать решение задачи ЗИБ 85 (Задачник Зильберман) цена 150р
Задача ЗИБ 86. Полимеризация винилового мономера протекает со скоростью 4,3 *10-6 моль*л-1*с-1. Вычислите скорость полимеризации, если концентрация мономера увеличилась в 1,3 раза, а концентрация инициатора уменьшилась в 1,2 раза. Кинетический порядок полимеризации по этим реагентам равен соответственно 1,4 и 0,8.
Скачать решение задачи ЗИБ 86 (Задачник Зильберман) цена 150р
Задача ЗИБ 87. Кинетический порядок полимеризации винилового мономера по одному из компонентов окислительно-восстановительной системы равен 0,8. При определенной концентрации этого компонента начальная скорость полимеризации была 3,5*10-5 моль*л-1*с-1. Какой будет скорость полимеризации, если концентрацию инициатора увеличить в 1,5 раза?
Скачать решение задачи ЗИБ 87 (Задачник Зильберман) цена 150р
Задача ЗИБ 88. Определите порядок реакции по мономеру при полимеризации метакрилата натрия в присутствии персульфата калия, если известно, что при концентрациях мономера, равных 0,62, 0,93, 1,12, 1,39 моль*л-1, скорость полимеризации составляла соответственно 0,784 *10-4, 1,12*10-4, 1,34*10-4, 1,68*10-4 моль*л-1*с-1. Оцените среднеквадратичную ошибку определения порядка реакции.
Скачать решение задачи ЗИБ 88 (Задачник Зильберман) цена 150р
Задача ЗИБ 89. Из экспериментальных данных известно, что при концентрациях персульфата калия, равных 1,3*10-3, 2,6*10-3, 3,9*10-3, 5,2*10-3 моль*л-1, скорость полимеризации водного раствора метакрилата натрия составляла соответственно 0,69*10-4, 0,92*10-4, 1,14*10-4, 1,33*10-4 моль*л-1*с-1. Определите порядок реакции по иниатора и оцените среднеквадратичную ошибку.
Скачать решение задачи ЗИБ 89 (Задачник Зильберман) цена 150р
Задача ЗИБ 91. Рассчитайте значение ko при полимеризации метакриловой кислоты в диметилсульфоксиде (20°С), если известно, что kр : ko0,5 = 0,051 л0,5 *(моль*с)-0,5, а kр описывается уравнением, параметры которого приведены в приложении III.
Скачать решение задачи ЗИБ 91 (Задачник Зильберман) цена 150р
Задача ЗИБ 92. Определите значение kp и k0 (40оС) при полимеризации метакриловой кислоты в среде диметилсульфоксида, если из экспериментальных данных известно, что kр ko = 0,34*10-4, а kрko0,5 = 0,103 л0,5 *(моль*с)-0,5.
Скачать решение задачи ЗИБ 92 (Задачник Зильберман) цена 150р
Задача ЗИБ 93. Вычислите отношение стационарных концентраций свободных радикалов при полимеризации в одинаковых условиях винилхлорида и метилметакрилата. Температура полимеризации 50 и 70 °С. Данные об элементарных реакциях приведены в приложении III.
Скачать решение задачи ЗИБ 93 (Задачник Зильберман) цена 150р
Задача ЗИБ 99. Какой концентрации мономера соответствует среднее время существования единичного радикала при полимеризации винилхлорида в растворе, равное 1,63*10-4 с. если kр = 12,3*103 л*моль-1*с-1?
Скачать решение задачи ЗИБ 99 (Задачник Зильберман) цена 150р
Задача ЗИБ 100. При радикальной полимеризации, протекающей с начальной скоростью 4,0*10-5 моль*л-1*с-1 время, за которое длина цепи увеличивается на одно звено, составляет 0,0012 с. Вычислите скорость инициирования, если kо=0,6*107 л*моль-1*с-1.
Скачать решение задачи ЗИБ 100 (Задачник Зильберман) цена 150р
Задача ЗИБ 101. Вычислите среднюю продолжительность роста кинетической цепи при полимеризации 1 М раствора метилметакрилата, если kp:ko=2,76*10-5 (60 °С). а начальная скорость полимеризация составляет 8,4*10-6 моль*л-1*с-1.
Скачать решение задачи ЗИБ 101 (Задачник Зильберман) цена 150р
Задача ЗИБ 102. При полимеризации акриламида в воде при 25 °С были найдены значения kp и ko для pH 1 (1,72*104 и 16,3*106 л*моль-1*с-1) и pH 13 (0,4*104 и 1,0*106 л*моль-1*с-1). Вычислите, как при прочих равных условиях в стационарном режиме относятся скорости полимеризации, концентрации свободных радикалов, средние продолжительности роста кинетической цепи, длины кинетической цепи и продолжительности жизни единичных радикалов.
Скачать решение задачи ЗИБ 102 (Задачник Зильберман) цена 150р
Задача ЗИБ 103. Определите среднее время роста кинетической цепи в стационарном состоянии при полимеризаций в массе метакрилонитрила (20 оС), если kр:k0 = 1,04*10-6, начальная длина кинетической цепи равна 1200, а скорость инициирования составляет 4,7*10-9 моль*л-1*с-1.
Скачать решение задачи ЗИБ 103 (Задачник Зильберман) цена 150р
Задача ЗИБ 104. Определите среднее время, за которое кинетическая цепь увеличивается на одно звено, если kр полимеризации 1,5 М раствора мономера составляет 4,5 *103 л*моль-1*с-1.
Скачать решение задачи ЗИБ 104 (Задачник Зильберман) цена 150р
Задача ЗИБ 105. Полимеризация винилового мономера протекает в присутствии ингибирующих примесей при скорости инициирования 2,8*10-9 моль*л-1*с-1. Длина кинетической цепи стационарной концентрации свободных радикалов 7*10-10 моль*л-1 составляет 250. Определите среднее время жизни единичного радикала.
Скачать решение задачи ЗИБ 105 (Задачник Зильберман) цена 150р
Задача ЗИБ 107. Оцените значение константы передачи цепи на регулятор молекулярной массы при полимеризации метилметакрилата ([М]=5,7моль*л-1, 25 оС), если при концентрациях этого агента 0,8*10-3 и 2,0*10-3 моль*л-1 при прочих равных условиях образуется полимер со среднечисловой молекулярной массой 2,57*105 и 1,26 *105 соответственно.
Скачать решение задачи ЗИБ 107 (Задачник Зильберман) цена 150р
Задача ЗИБ 109. Рассчитайте начальную среднечисловую степень полимеризации акрилонитрила в массе в присутствии 2,2'-азо-бис-изобутиронитрила в качестве инициатора, если относительная константа передачи цепи на мономер равна 0,26* 10 -4, а без учета передачи цепи на мономер средне числовая степень полимеризации составила бы 1500.
Скачать решение задачи ЗИБ 109 (Задачник Зильберман) цена 150р
Задача ЗИБ 110. Вычислите начальную относительную константу передачи пени на растворитель, если при полимеризации винилацетата в циклогексане в присутствии 2,2'-азо-бис-изобутиронитрила получен полимер со средне числовой степенью полимеризации 90, См = 2,8*10-4. В отсутствие реакции передачи цепи степень полимеризации была бы равна 1800, мольное соотношение растворителя и мономера 15.
Скачать решение задачи ЗИБ 110 (Задачник Зильберман) цена 150р
Задача ЗИБ 112. Вычислите начальную среднечисловую степень полимеризации при отсутствии реакций передачи цепи, если длина кинетической цепи равна 2400, а 80 % актов обрыва происходит путем рекомбинации.
Скачать решение задачи ЗИБ 112 (Задачник Зильберман) цена 150р
Задача ЗИБ 113. При полимеризации I М раствора стирола при 70 °С в присутствии перекиси лауроила (0,01 М, CI- 0,024) получен полимер со среднечисловой степенью полимеризации 1050. Какой будет начальная степень полимеризации, если заменить перекиси лауроила 2,2’-азо-бис-изобутиронитрилом, количество которого подбирается таким образом, что сохраняется начальная скорость полимеризации.
Скачать решение задачи ЗИБ 113 (Задачник Зильберман) цена 150р
Задача ЗИБ 114. Вычислите начальную скорость инициирования, обесценивающую получение из N,N-диметилакриламида полимер с Xл = 3*103 при скорости полимеризации 2,25*10-5 моль*л-1*с-1, если полимеризация проводится в массе в присутствии инициатора, не участвующего в передаче цепи. Допускается, что обрыв цеци осуществляется путем рекомбинации, а См=1,5*10-4.
Скачать решение задачи ЗИБ 114 (Задачник Зильберман) цена 150р
Задача ЗИБ 115. Вычислите, какой должна быть начальная скорость полимеризации 1 М раствора акриламида в воде, обеспечивающая образование при 25 °С полимера с начальной среднечисловой молекулярной массой 3 *106, если kр: kо0,5 =4,2 л0,5*(моль*с)-0,5, См=0,13*10-4,СI=0. Допускается, что 60% радикалов обрывается в результате диспропорционирования.
Скачать решение задачи ЗИБ 115 (Задачник Зильберман) цена 150р
Задача ЗИБ 118. Какой должна быть концентрация инициатора (2.2-азо-бис-изобутиронитрил) при полимеризации метилметакрилата в массе (60 оС), обеспечивающая получение полимера с начальной среднечисловой степенью полимеризации 2000, если См =0,12*10-4, 60% реакций обрыва протекает за счет диспропорционирования, kр:kо0,5 = 1,36 *10-2 л0,5*(моль*с)-0,5 описывается уравнением, приведенным в приложении I, f=0,6.
Скачать решение задачи ЗИБ 118 (Задачник Зильберман) цена 150р
Задача ЗИБ 119. Рассчитайте распределение (i%) концевых групп (осколки инициатора, остатки молекул растворителя, группировки на основе молекул стирола, содержащие и не содержащие двойных связей) в полистироле, полученном на начальной стадии полимеризации стирола (1 М) в циклогексане в присутствии перекиси ди-тpeт-бутила (0,01 М), исходя из следующих данных: Сi = 3,2*10-4, См =8,0* 10-5, Cs = 3,1*10-6 скорость полимеризации 1,5*10-7 моль * л-1* с-1 скорость инициирования 4,0* 10-11 моль л-1 с-1, концентрация растворителя при температуре полимеризации 8 моль*л-1, обрыв происходит путем рекомбинации. Передача цепи на мономер и растворитель происходит путем переноса к ним атома водорода от растущего радикала.
Скачать решение задачи ЗИБ 119 (Задачник Зильберман) цена 150р
Задача ЗИБ 120. Полимеризацией стирола (0,5М) в относительно инертном растворителе получен полимер с начальной среднечисловой степенью полимеризации 2500. сколько следует добавить четыреххлористого углерода (Сs=9*10-3), чтобы степень полимеризации уменьшить в 2 раза?
Скачать решение задачи ЗИБ 120 (Задачник Зильберман) цена 150р
Задача ЗИБ 121. Зная константу скорости инициирования (kи = 3,3 *10-8 с-1), начальную скорость полимеризации (Rр = 4,3 10-7 моль*л-1*с-1) и концентрацию инициатора (0,005 М), вычислите начальную длину кинетической цепи. Какова степень полимеризации при обрыве путем рекомбинации, диспропорционирования и одновременно обоими путями в соотношении 1:1, если пренебречь передачей цепи?
Скачать решение задачи ЗИБ 121 (Задачник Зильберман) цена 150р
Задача ЗИБ 123. Зная значения [М], [S], kи, kр :kо0,5. СI, См, Сs, характер обрыва цепи (см. задачу 122), а также начальную скорость полимеризации, равную 1,1 *10-6 моль*л-1*c-1, вычислите, каковы начальная степень полимеризации и концентрация инициатора.
Скачать решение задачи ЗИБ 123 (Задачник Зильберман) цена 150р
Задача ЗИБ 124. При полимеризации стирола в массе в присутствии ацильной перекиси получен полимер с начальной среднечисловой степенью полимеризации 1950 при длине кинетической цепи 1850. Вычислите, какой будет степень полимеризации, если за счет изменения концентрации инициатора скорость полимеризации увеличить в 1,5 раза. Относительная константа скорости передачи цепи на мономер равна 0,7*10-4, обрыв цепи основан на рекомбинации радикалов.
Скачать решение задачи ЗИБ 124 (Задачник Зильберман) цена 150р
Задача ЗИБ 125. Начальная среднечисловая степень полимеризации метилметакрилата в массе равна 2100, а скорость инициирования 5,5 *10-9 моль*л-1*с-1. Инициатор не взаимодействует с макрорадикалами. Вычислите скорость полимеризации, если 60% макрорадикалов обрывается путем рекомбинации, а константа скорости роста цепи в 9*103 раз больше константы скорости передачи лепи на мономер.
Скачать решение задачи ЗИБ 125 (Задачник Зильберман) цена 150р
Задача ЗИБ 126. Для реакции полимеризации 1 М раствора винилового соединения известны следующие константы: kр: ko0,5= 0,16л0,5*(моль*с)-0,5, См=0,81*10-4, Сs=0,27*10-4, CI=0,055. Вычислите начальную среднечисловую степень полимеризации, если скорость полимеризации 4,5 *10-5 моль*л-1*с-1 и 60% макрорадикалов обрываются путем рекомбинации. Полимеризация проводилась в присутствии инициатора с kr = 0,15*10-4с-1, f=1, концентрация растворителя 12 моль*л-1.
Скачать решение задачи ЗИБ 126 (Задачник Зильберман) цена 150р
Задача ЗИБ 137. Вычислите долю радикалов, обрыв которых осуществляется путем диспропорционирования, если полимер (5 г), полученный в массе в присутствии меченного углеродом-14 2,2'-азо-бис-изобутиронитрила в качестве инициатора, имеет активность 134 импульса в минуту и среднечисловую степень полимеризации 1,15*104. Активность инициатора составляет 5,41*105 имп/мин на 1 г, молекулярная масса мономера 110, константа передачи цепи на мономер 4 *105.
Скачать решение задачи ЗИБ 137 (Задачник Зильберман) цена 150р
Задача ЗИБ 144. Вычислите ожидаемые начальные значения Xw и коэффициента полидисперсности винилового полимера, полученного в органическом растворителе с Сs 1,1 *10-2, если мощное соотношение растворителя и мономера равно 5,5:1. Скорость полимеризации больше скорости инициирования на несколько порядков.
Скачать решение задачи ЗИБ 144 (Задачник Зильберман) цена 150р
Задача ЗИБ 151. Покажите, что отношение макромолекул, образованных в результате реакций диспропорционирования и передачи цепи на мономер и образованных в результате реакции рекомбинации, при полимеризации винилового мономера в массе равно 2(λ + vCM): (1 - λ). Передачи цепи на инициатор нe происходит.
Скачать решение задачи ЗИБ 151 (Задачник Зильберман) цена 150р
Задача ЗИБ 152. Доля молекул, при образовании которых на стадии обрыва происходила реакция рекомбинации, составляет 0,35. Вычислите долю радикалов, обрывающихся путем рекомбинации, если Rp = 8,1 *10-6 моль *л-1*с-1, Rи = 1,2 *10-9 моль*л-1*с-1, а См = 5,6 *10-5. Другие реакции передачи цепи не имеют места.
Скачать решение задачи ЗИБ 152 (Задачник Зильберман) цена 150р
Задача ЗИБ 156. Рассчитайте начальную скорость полимеризации виацетата в I М растворе при 70 °С в присутствии 10-3 моль*л-1 ’ инициатора, если энергия активации гомологического распада инициатора равна 124 кДж *моль-1. Константа скорости распада при 85 оС составляет 4,7 *10-5 с-1 эффективность инициирования 0,8. Энергии активации и предэкспоненциальные множители уравнений Аррениуса для расчета констант скоростей роста и обрыва приведены в приложении III.
Скачать решение задачи ЗИБ 156 (Задачник Зильберман) цена 150р
Задача ЗИБ 157. Вычислите начальную длину кинетической цепи при 60, 70 и 80оС для полимеризации винилацетата в условиях, приведенных в задаче 156.
Скачать решение задачи ЗИБ 157 (Задачник Зильберман) цена 150р
Задача ЗИБ 158. Вычислите среднечисловую молекулярную массу полиизо-метакрилата при полимеризации изобутилметакрилата в массе (45 оС), если См описывается уравнением, приведенным в приложении IV, kp: ko0,5 =3,2*10-2 л0,5*(моль*с)-0,5, скорость полимеризации равна 4,75*10-5 моль*л-1*с-1. Обрыв цепи осуществляется реакцией рекомбинации. Изменением объема реакционной смеси с повышением температуры пренебречь.
Скачать решение задачи ЗИБ 158 (Задачник Зильберман) цена 150р
Задача ЗИБ 173. Вычислите степень превращения мономера к моменту, когда концентрация свободных радикалов достигает 95 % от стационарной, если Rи=8,1*10-9 моль*л-1*с-1, kр=2,9*103 л*моль-1*с-1, kо=7,8*107 л*моль-1*с-1.
Скачать решение задачи ЗИБ 173 (Задачник Зильберман) цена 150р
Задача ЗИБ 177. При фотохимическом инициировании интенсивность поглощенного света соответствует 6,8 *10-9 моль*л-1*с-1 квантовый выход 0,25. Константы скорости роста и обрыва равны соответственно 5,8*103 и 4,6*107 л*моль-1*с-1. Вычислите скорость полимеризации 1 М раствора мономера в момент времени, равный половине длительности пре-эффекта Допускается, что за все время пре-эффекта концентрация свободных радикалов достигает 99% от стационарной.
Скачать решение задачи ЗИБ 177 (Задачник Зильберман) цена 150р
Задача ЗИБ 178. Зависимость степени превращения мономера от времени в течение пре-эффекта представлена ниже:
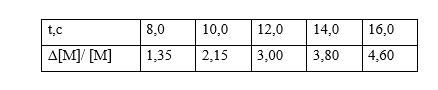
Определите среднее время роста кинетической цепи и отношение констант скорости роста и обрыва (при условии, что t > τ).
Скачать решение задачи ЗИБ 178 (Задачник Зильберман) цена 150р
Решение задач по технологии полимеров Зильберман часть1
Решение задач по технологии полимеров Зильберман (П)
Задача ЗИБП 1. Для инициирования радикальной полимеризации в растворе необходимо получить 1,5-1015 радикалов на 1 мл реакционной смеси в 1 с. Сколько для этого потребуется перекиси лауроила, если эффективность инициирования 0,5, а константа скорости распада инициатора при температуре полимеризации 6,0*10-4 с-1?
Скачать решение задачи ЗИБП 1 (Задачник Зильберман) цена 50р
Задача ЗИБП 2. Период полураспада дибутилпероксидикарбоната при температуре полимеризации 20 ч, средняя эффективность инициирования 0,7. Вычислите количество участвующих в реакции инициирования радикалов, образующихся в течение 10 ч из 0,1 моль инициатора. Допускается, что kг в ходе реакции неизменна.
Скачать решение задачи ЗИБП 2 (Задачник Зильберман) цена 50р
Задача ЗИБП 3. Константы скорости распада дициклогексилпероксидикарбоната при 50 и 600 оС равны соответственно 8,46*10-3 и 34,8*10-5 с-1. Вычислите значение этой константы, энтальпию и энтропию активации реакции при 40 оС.
Скачать решение задачи ЗИБП 3 (Задачник Зильберман) цена 50р
Задача ЗИБП 4. Сколько радикалов войдет в состав полимера при полимеризации 0,8 л стирола в присутствии перекиси бензоила и диметиланилина, если средняя эффективность инициирования равна 0,25, а содержание перекиси и амина по 0,087 моль*л-1. Степень превращения инициатора 60%.
Скачать решение задачи ЗИБП 4 (Задачник Зильберман) цена 50р
Задача ЗИБП 5. Квантовый выход инициирования равен 0,5. Ртутная лампа излучает 32,6 Дж*с-1 света при длине волны 2,53*10-7 м. Предполагая, что мономер поглощает весь падающий свет, определите, сколько радикалов приняло участие в образовании кинетических цепей в течение 3ч.
Скачать решение задачи ЗИБП 5 (Задачник Зильберман) цена 50р
Задача ЗИБП 6. При какой толщине поглощающего слоя мономера (концентрация 0,35 моль • л-1) скорость фотохимического инициирования равна 6,39 * 10-8 моль* л-1 *с-1, если квантовый выход инициирования составляет 0,02, молярный коэффициент экстинкции мономера равен 24 л *см-1, λ=219нм. На 1,25 л раствора мономера падает свет с энергией 43,33раствора мономера падает свет с анергией 43,33*10-4 кДж* с-1.
Скачать решение задачи ЗИБП 6 (Задачник Зильберман) цена 50р
Задача ЗИБП 7. Эффективность радиационного инициирования полимеризации метилметакрилата 7,5. Определите количество реакционных цепей, образовавшихся в течение 7 мин, если мощность поглощенной дозы β-частиц (60Со) составляет 0,93*103 МэВ*с-1 .
Скачать решение задачи ЗИБП 7 (Задачник Зильберман) цена 50р
Задача ЗИБП 8. При полимеризации 0,1н раствора винилового мономера эффективность инициирования равна 0,5. Оцените ожидаемое значение эффективности инициирования, если при уменьшении концентрации мономера в два раза при прочих равных условиях значения констант скорости не изменяются.
Скачать решение задачи ЗИБП 8 (Задачник Зильберман) цена 50р
Задача ЗИБП 9. Составьте материальный баланс по 2,2-азо-бисизобутиронитрилу, инициирующему полимеризацию, протекающую при 62 оС в течение 5 ч. Получаемая реакционная смесь подвергается нагреванию при 70 оС в течение 30 мин. Принимается, что средняя эффективность инициирования равна 0,6, а 50% радикалов, не участвующих в инициировании, вступают в реакцию диспропорционирования. Для вычисления скорости гомолитического распада инициатора используйте параметры, приведенные в приложении I. Расчет ведите на 1 кг инициатора.
Скачать решение задачи ЗИБП 9 (Задачник Зильберман) цена 50р
Задача ЗИБП 10. При полимеризации расплавленного водного раствора акритомида (50°С) в присутствии 2,27*10-3 моль*л-1 пересульфата калия наблюдается следующее изменение константы смолитического распада иницитора и эффективности инициирования во времени
т, мин 0 15 30 45 60 75 90
к*106, с-1 4,8 4,6 3,5 3,2 3,0 2,8 2,5
f 1,0 0,79 0,66 0,62 0,56 0,44 0,41
Определите скорость инициирования через 80мин. от начала реакции. Как изменилась скорость инициирования по сравнению с начальной ее величиной
Скачать решение задачи ЗИБП 10 (Задачник Зильберман) цена 50р
Задача ЗИБ 21. Константа скорости распада диэтилпероксидикарбоната в трет-бутиловом спирте при 45 оС равна 1,25*10-5 с-1. Каково значение этой же константы при 55 оС, если энергия активации распада составляет 138,2 кДж моль-1?
Скачать решение задачи ЗИБ 21 (Задачник Зильберман) цена 150р
Задача ЗИБ 23. Начальное содержание перекиси ацетила составляет 6,549 г в 300 мл мономера (при температуре реакции). На начальной стадии реакции в 1 мин в образовании кинетических цепей принимает участие 3,765 10-4 моль инициатора. Определите эффективность инициирования, если активационные параметры реакции распада при 80 оС составляют соответственно 53,09 Дж моль-1 К-1 и 133,1 кДж*моль-1
Скачать решение задачи ЗИБ 23 (Задачник Зильберман) цена 150р
Задача ЗИБ 24. Энтропия активации реакции распада перекиси кумола при 115оС равна 91,98 Дж моль-1К-1, энтальпия активации 167,2 кДж*моль-1. Определите константу скорости реакции и вычислите какая доля инициатора останется в растворе через 45 мин после начала реакции. Константа скорости в ходе процесса не меняется.
Скачать решение задачи ЗИБ 24 (Задачник Зильберман) цена 150р
Задача ЗИБ 25. Определите активационные параметры реакции распада трет-бутидпероксиацетата при 120 оС, если периоды полураспада его при 140 и 100 оС составляют соответственно 10 и 840 мин.
Скачать решение задачи ЗИБ 25 (Задачник Зильберман) цена 150р
Задача ЗИБ 26. Скорость инициирования при полимеризации 1 л стирола под действием света мощностью 25,6 Вт при длине волны 3660 А равна 8,75*10-8 моль*с. Определите квантовый выход инициирования при условии, что весь падающий свет поглощается мономером.
Скачать решение задачи ЗИБ 26 (Задачник Зильберман) цена 150р
Задача ЗИБ 27. При фотохимическом инициировании полимеризации метилметакрилата число радикалов, образовавшихся при поглощении одного кванта света (λ= 313 нм), равно 0,2. Скорость поглощения света составляет 3,25 10-2 Дж л-1 с-1. Определите скорость инициирования.
Скачать решение задачи ЗИБ 27 (Задачник Зильберман) цена 150р
Задача ЗИБ 28. Определите квантовый выход инициирования 2,2 л стирола под действием света с длиной волны 0,366 нм, если интенсивность поглощаемого света 4,82*10-3 Дж с-1, а в каждую минуту образуется 14*10-8 моль кинетических цепей.
Скачать решение задачи ЗИБ 28 (Задачник Зильберман) цена 150р
Задача ЗИБ 29. Константа скорости распада (бензол, 50 оС) перекиси бензоила равна 0,048 10 5 с-1, а трет-бутилпероксидикарбоната - 8,85 10-5 с-1. Приняв эффективность инициирования 0,6 и 0,8 и массу инициаторов - соответственно 27,225 и 26,325 I , определите соотношение скоростей инициирования в начальный момент времени, через 20 мин и через 5 ч от начала реакции, если объемы реакционных смесей при темпе¬ратуре опыта одинаковы, а константы скорости и эффективность можно считать неизменными в ходе реакций.
Скачать решение задачи ЗИБ 29 (Задачник Зильберман) цена 150р
Задача ЗИБ 31. Определите скорость инициирования при фотополимеризации 1 л раствора мономера, если при поглощении одного кванта свела образуется в среднем 0,3 радикала. Концентрация мономера равна 0,12 моль*л-1, коэффициент экстинкции 12 л моль -1 с-1 толщина поглощающего слоя 0,5 см. Интенсивность падающего света при длине волны 293,5 нм составляет 200,1 10-7 кДж с-1.
Скачать решение задачи ЗИБ 31 (Задачник Зильберман) цена 150р
Задача ЗИБ 32. Значение эффективности инициирования при полимеризации 0,3 н. раствора винилового мономера равно 0,44. При какой концентрации мономера эффективность инициирования равна 0,28? В расчете допускается, что прочие условия полимеризации, а также значения элементарных констант скорости при переходе к новой концентрации мономера не меняются, а в побочных реакциях первичных радикалов мономер не принимает участия
Скачать решение задачи ЗИБ 32 (Задачник Зильберман) цена 150р
Задача ЗИБ 33. Какова эффективность инициирования при полимеризации винилового мономера, если отношение констант скорости k’’:k’ равно 0,15 моль л-1, а концентрация мономера составляет 2,0 моль л-1 ?
Скачать решение задачи ЗИБ 33 (Задачник Зильберман) цена 150р
Задача ЗИБ 34. При какой концентрации мономера эффективность инициирования составит 0,97, если отношение констант k' :k" равно 24,4 л моль -1 ?
Скачать решение задачи ЗИБ 34 (Задачник Зильберман) цена 150р
Задача ЗИБ 35. Определите эффективность инициирования при полимеризации винилового мономера, если известно, что Rпоб в 18 раз меньше Rи.
Скачать решение задачи ЗИБ 35 (Задачник Зильберман) цена 150р
Задача ЗИБ 37. Вычислите время, в течение которого при 60 оС 40% дициклогексилперкарбоната вступает во взаимодействие с мономером, если kг = 34,8 10-5. Сколько потребуется 2,2‘-азо-бис-изобутиронитрилаила (kг = 085 10-5 с-1,f=0,6), чтобы за тот же промежуток времени получить столько же свободных радикалов, реагирующих с мономером? Полученный результат выразите в виде мольного отношения между инициаторами. Участием дициклогексилперкарбоната в реакции с макрорадикалами пренебрегите.
Скачать решение задачи ЗИБ 37 (Задачник Зильберман) цена 150р
ПОЛИМЕРЫ Ровкина Ляпков 2 часть
Задача 5.1 Полимеризацию стирола проводят в каскаде из 2-х форполимеризаторов и колонном аппарате. Время пребывания реакционной массы в каждом форполимеризаторе 8 ч, а в колонном аппарате - 6 ч. Колонна имеет диаметр 1,2 м и высоту 11 м. Определить объемный расход стирола и число колонн для обеспечения форполимеризаторов вместимостью по 4 м3. Принять плотность стирола и реакционных масс одинаковыми.
Скачать решение задачи 5.1 (Задачник Ровкина Ляпков) 150р
Задача 5.2 Определите съем полимера с 1 м3 колонны непрерывной полимеризации стирола в блоке, если в нее поступает сироп из двух реакторов предварительной полимеризации со скоростью 40 и 39 кг/ч. Сироп содержит 30 % полистирола и 70 % стирола. Плотность стирола 905 кг/м3 полистирола — 1050 кг/м3. Время пребывания реакционной массы в колонне 30 ч. Полимер на выходе из колонны содержит 0,05 масс, долей мономера. Размер колонны: d = 0,7 м; h = 7 м.
Скачать решение задачи 5.2 (Задачник Ровкина Ляпков) 150р
Задача 5.3 Определите расход компонентов (м3/кг) для получения 25 т полистирола водоэмульсионным способом, если объемный модуль загрузки следующий: стирол, вода, касторовое масло (эмульгатор) в соотношении 1:2,5:0,03.
В реакционную смесь добавляют 0,0025 масс, долей (от массы мономера) персульфата калия (инициатор). Плотность стирола 905 кг/м3 а касторового масла 962 кг/м3. Полимер содержит 1 % примесей (по массе).
Скачать решение задачи 5.3 (Задачник Ровкина Ляпков) 200р
Задача 6.1 Промышленность в больших количествах выпускает сополимеры на основе хлористого винила, из которых наиболее востребованы сополимеры ХВ с винилацетатом, метилакрилатом и винилиденхлоридом. Сополимеры ХВ в промышленности получают теми же техническими методами, что и ПВХ, при этом чаще используется суспензионный и реже эмульсионный методы. Наиболее широк ассортимент сополимеров ХВ с ВА, имеющих разное назначение. Сополимер ХВ и ВА, содержащий 85+87 % ХВ, более термопластичен, чем ПВХ и ПВА, обладает большой эластичностью, влагостойкостью, растворимостью (кетоны, нитропарафины, хлорированные углеводороды), имеет хорошие диэлектрические свойства. Рассчитать загрузку компонентов для получения сополимеров ХВ согласно рецептам, приведенным в табл. 6.5.
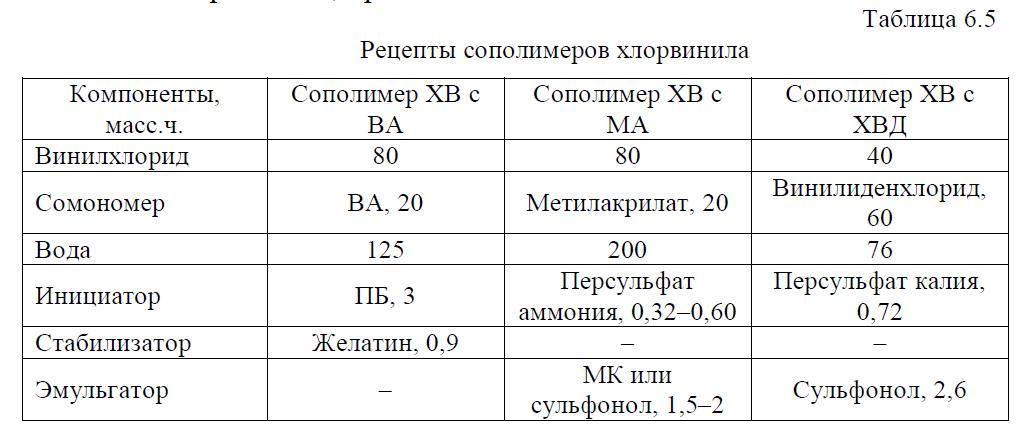
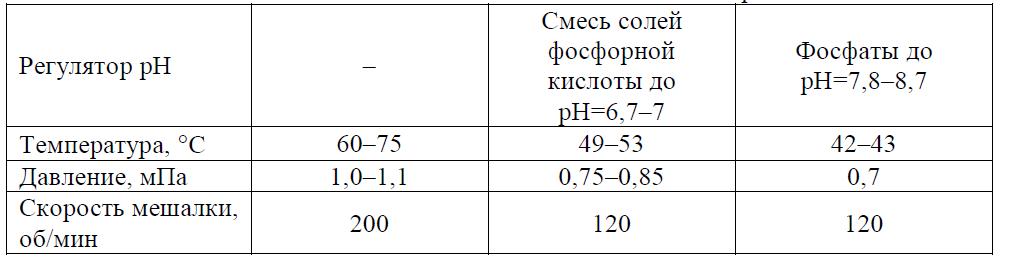
Скачать решение задачи 6.1 (Задачник Ровкина Ляпков) 150р
Задача 6.2 Для производства поливинилхлорида суспензионным методом использованы следующие вещества (в масс, долях): винилхлорид — 100; вода - 150; другие ингредиенты - 2. Рассчитайте массовую долю полимера в латексе, если конверсия составила 85 %, а в автоклав загружено 24 т сырьевых компонентов.
Задача 6.3 В качестве инициатора полимеризации винилхлорида эмульсионным способом используется 1,2%-й водный раствор персульфата калия, загрузка которого в автоклав составляет 1,5 % от массы мономера. Рассчитайте массу персульфата калия, введенного в полимеризатор, производительность которого 625 кг/ч (в расчете на полимер). Продолжительность процесса 20 ч, а конверсия винилхлорида составила 92 % (по массе).
Скачать решение задачи 6.3 (Задачник Ровкина Ляпков) 150р
Задача 6.4 Рецепт эмульсионной периодической полимеризации винилхлорида следующий:
водная фаза - 3,7 м3;
винилхлорид - 4,2 м3 (р = 969,2 кг/м3);
инициатор (40%-й раствор Н2О2) — 18 кг;
эмульгатор — 182 кг.
Вычислите выход полимера, если через 20 ч полимеризации и удаления незаполимеризовавшегося винилхлорида на коагуляцию подано 7767,1 кг латекса.
Скачать решение задачи 6.4 (Задачник Ровкина Ляпков) 150р
Задача 6.5 Сколько взято для полимеризации эмульсионным методом винилхлорида и водной фазы, если объем автоклава 25 м3, а коэффициент его заполнения 0.9. Латекс, выходящий из полимеризатора, имеет плотность 1150 кг/м3 и содержит 0,42 массовые доли поливинилхлорида. Конверсия мономера — 92 %.
Скачать решение задачи 6.5 (Задачник Ровкина Ляпков) 150р
Задача 6.6 Определите суточную производительность реактора суспензионной полимеризации винилхлорида, используя следующие исходные данные: объем полимеризатора — 65 кг; коэффициент заполнения — 0.9; объемный модуль загрузки (отношение мономера к воде) 1:1,2; продолжительность полимеризации 10ч; выход полимера 95 % (от массы винилхлорида); плотность жидкого винилхлорида, подаваемого в реактор, 937 кг/м3.
Задача 6.7 Рассчитайте рабочий объем автоклава эмульсионной полимеризации винилхлорида, если из него за один цикл выгружено 24,44 т латекса плотностью 1150 кг/м3. коэффициент заполнения автоклава — 0,85.
Скачать решение задачи 6.7 (Задачник Ровкина Ляпков) 150р
Задача 6.8 Производительность автоклава суспензионной полимеризации винилхлорида составляет 20 т/сут (в расчете на винилхлорид). Определите объем сжиженного винилхлорида, воды и массу инициатора, если продолжительность полимеризации 12 ч. При расчетах учесть, что для данного типа полимера расход воды и инициатора составляет, соответственно, 100 и 0,5 % от массы мономера. Плотность жидкого винилхлорида - 973 кг/м3, конверсия винилхлорида — 90 %. Рассчитайте объем автоклава, если коэффициент его заполнения составил 0,91.
Скачать решение задачи 6.8 (Задачник Ровкина Ляпков) 150р
Задача 7.1 Рассчитать количество форм для окончательной полимеризации сиропа, полученного на стадии форполимеризации, для получения оргстекла с размером листов 800x500x3 мм.
Усадку полимера принять равной 20 %, а плотность сиропа рассчитать, зная, что сироп содержит 15 % полиметилметакрилата, плотность которого равна 1185 кг/м3 остальное — метилметакрилат с плотностью 945 кг/м3. Принять потери полимера при обрезке листов по формату равными 0,01 %.
Скачать решение задачи 7.1 (Задачник Ровкин Ляпков) 150р
Задача 7.2 Рассчитайте массы метилметакрилата, пластификатора (дибутилфталата) и инициатора для получения 250 блоков полиметилметакрилата, если в стеклянные формы размером 1200x1800x5 мм заливается метакрилат, содержащий 0,5 % инициатора и 4 % пластификатора (от массы мономера). Плотность метилметакрилата 924 кг/м3.
Скачать решение задачи 7.2 (Задачник Ровкин Ляпков) 150р
Задача 8.1 Рассчитать возможность желатинизации алкида, рецептура которого и необходимые данные приведены в табл. 8.13.
Таблица 8.13 Рецептура загрузки компонентов
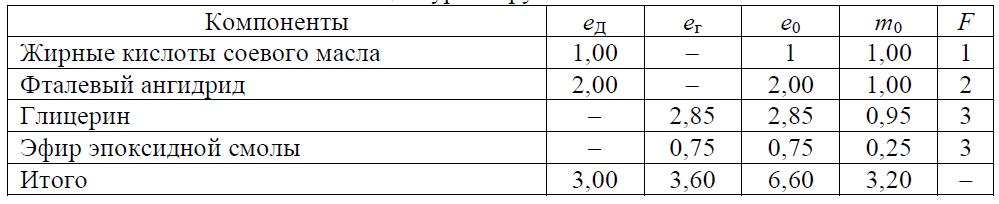
Эфир эпоксидной смолы, полученной при взаимодействии 59 вес.% смолы Эпон 1001 с молекулярной массой 875 и функциональностью 6,0 с 41 % масс, лауриновой кислоты.
Скачать решение задачи 8.1 (Задачник Ровкина Ляпков) 150р
Задача 8.2 Рассчитать полноту реакции для тощего алкида по рецепту в табл. 8.14.
Таблица 8.14 Рецептура загрузки компонентов
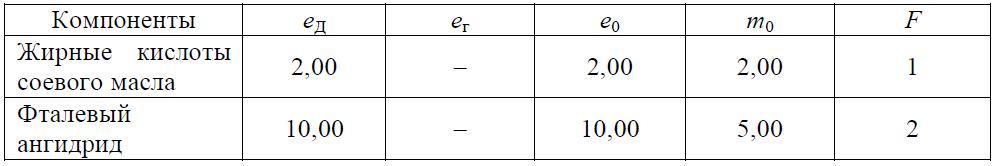
Задача 8.3 Рассчитать рецептуру алкида на основе соевого масла, изофталевой кислоты и глицерина при условии, что избыток гидроксильных групп составляет 18 %.
Скачать решение задачи 8.3 (Задачник Ровкина Ляпков) 150р
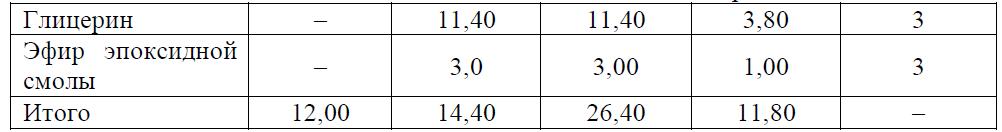
Задача 8.4 Определить полноту реакции в момент желатинизации для алкида, полученного при мольном соотношении компонентов, приведенном в табл. 8.15.
Таблица 8.15 Средняя функциональность компонентов реакционной смеси
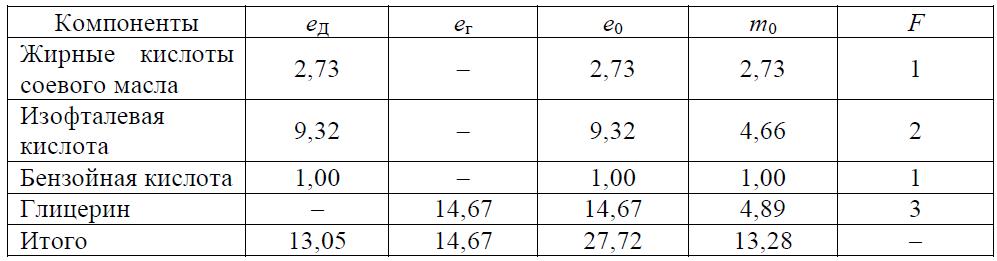
Задача 8.5 Определить полноту реакции в момент желатинизации для лака, рецепт которого приведен в табл. 8.16.
Таблица 8.16 Рецептура загрузки компонентов
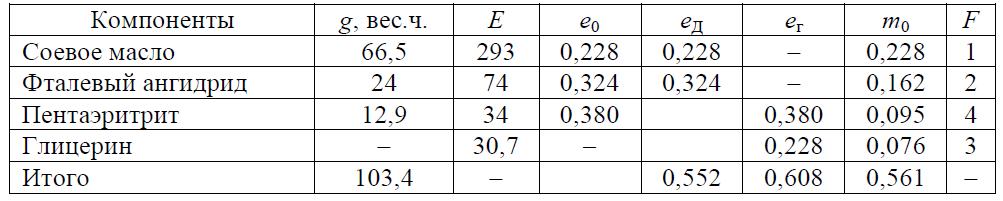
Скачать решение задачи 8.5 (Задачник Ровкина Ляпков) 150р
Задача 9.1 Рассчитать загрузку реагентов в периодический кубовый реактор емкостью 5 мл и коэффициентом заполнения 0,65 для получения различных марок фенолоальдегидных смол новолачного типа согласно рецептам, представленным в табл. 9.3 по заданию преподавателя.
Таблица 9.3 Рецепты новолачных фенолоальдегидных смол
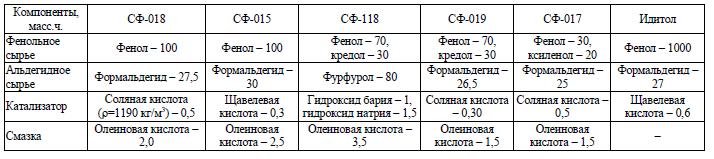
Скачать решение задачи 9.1 (Задачник Ровкина Ляпков) 200р
Задача 9.2 Рассчитать загрузку реагентов в периодический кубовый реактор емкостью 6,3 мэ с коэффициентом заполнения 0,75 для получения резольных фенолоальдегидных смол по рецептам, приведенным в табл. 9.4. Рассчитать количество выделяющейся теплоты в условиях одного из рецептов примера 9.4 или 9.5. если при новолачной поликонденсации выделяется 588,6 кДж на 1 кг прореагировавшего фенола, а при образовании резольных смол - 335,2 кДж/кг. Остаточное содержание фенола принять для новолачных смол равным не более 4 %, а для резольных - не более 9 %.
Таблица 9.4 Рецепты новолачных фенолоальдегидных смол
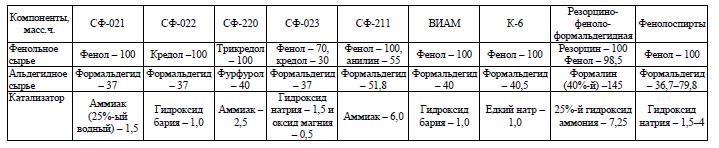
Скачать решение задачи 9.2 (Задачник Ровкина Ляпков) 200р
Задача 9.3 Рассчитать количество выделяющейся теплоты в условиях одного из рецептов табл. 9.4. если при поликонденсации выделяется 588,6 кДж на 1 кг прореагировавшего фенола. Остаточное содержание фенола в смоле принять равным 4 %.
Таблица 9.4 Рецепты новолачных фенолоальдегидных смол
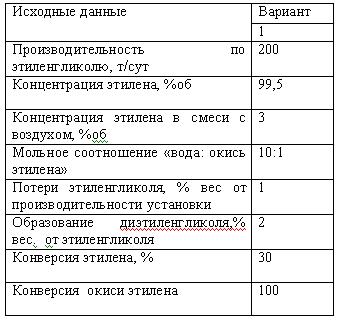 Скачать решение задачи 9.3 (Задачник Ровкина Ляпков) 200р
Скачать решение задачи 9.3 (Задачник Ровкина Ляпков) 200р
Задача 9.4 Рассчитать количество выделяющейся теплоты в условиях одного из рецептов табл. 9.5, если при поликонденсации выделяется 335,2 кДж на 1 кг прореагировавшего фенола. Остаточное содержание фенола — 9%.
Скачать решение задачи 9.4 (Задачник Ровкина Ляпков) 200р
Задача 9.5 Рассчитайте степень поликонденсации новолачной фенолформальдегидной смолы, если средняя молекулярная масса - 648.
Скачать решение задачи 9.5 (Задачник Ровкина Ляпков) 200р
Задача 9.6 Какая получается смола: резольная или новолачная, если для поликонденсации израсходовано 15 кг фенола и 7,5 л формалина (содержание СН2О в формалине около 40 г в 100 мл).
Скачать решение задачи 9.6 (Задачник Ровкина Ляпков) 200р
Задача 9.7 Рассчитайте теоретические расходные коэффициенты сырья при производстве 1 т новолачной смолы, если фенол берут 91%-й чистоты, а формалин содержит (по массе) — 37 % формальдегида (его плотность 1100 кг/м3). Формулу смолы принять
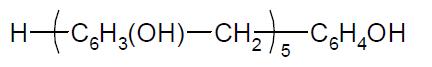
Скачать решение задачи 9.7 (Задачник Ровкина Ляпков) 200р
Задача 9.8 При образовании новолака выделяется 0,6 кг воды и 36 кДж теплоты из расчета на 1 кг прореагировавшего фенола. Определите выделившуюся теплоту и массу воды, если для получения новолака израсходовано 200 кг формалина, а мольные соотношения фенола и формальдегида - 7:6. Массовая доля формальдегида в формалине - 0,37.
Скачать решение задачи 9.8 (Задачник Ровкина Ляпков) 200р
Задача 9.9 Рассчитать загрузку компонентов в барабанный смеситель на одну операцию получения порошкообразных пластических масс на основе фенолоальдегидных связующих по одному из нижеприведенных рецептов в табл. 9.5. На 1 м3 объема смесителя загружают 2007250 кг смеси компонентов. Емкость смесительного барабана — 10м.
Скачать решение задачи 9.9 (Задачник Ровкина Ляпков) 200р
Задача 9.10 Рассчитать ионообменную колонну для сорбции ионов платины анионитом АВ-17-8 в кипящем слое. Количество кислого водного раствора, поступающего в колонну, равно 15 м3 ч. Концентрация платины в поступающем растворе Со = 150 м3/ч, а в выходящем из колонны растворе — Ск=0,1 г/м3. Содержание платины в анионите на входе в колонну С0 = 30 кг платины/м3. Средний диаметр частиц ионита 0,069 см. Коэффициент массопередачи, отнесенный к единице объема зерен ионита kv =0.08 с-1, порозность псевдоожиженного слоя е=0.6. Плотность частиц набухшего анионита АВ-17-8 составляет: р=1520 кг/м3.
Скачать решение задачи 9.10 (Задачник Ровкина Ляпков) 200р
Задача 9.11 Рассчитать число непрерывных реакторов ленточного типа и длительность ацетилирования в каждом таком реакторе при производстве ацетатов целлюлозы. Исходные данные: производительность реакторов - 2000 кг ч; ширина ленты - 1,7м; длина одного ленточного реактора — 40 м; высота слоя продукта на ленте — 0.25 м; плотность влажного продукта на ленте - 800 кг/м3; скорость движения ленты - 2 м/ч.
Скачать решение задачи 9.11 (Задачник Ровкина Ляпков) 200р
Задача 9.12 Рассчитать коэффициент теплопередачи от теплоносителя к реакционной массе реактора поликонденсации диэтиленгликоль-терефталата, если коэффициент теплоотдачи от теплоносителя к стенке аппарата равен 881 Вт/м*К, а коэффициент теплоотдачи от стенки аппарата к реакционной массе равен 800 Вт(м*К), толщина стенки 11 мм, коэффициент теплопроводности материала равен 17,5 Вт/м*К.
Скачать решение задачи 9.12 (Задачник Ровкина Ляпков) 200р
Задача 9.13 Перхлорвинил получают хлорированием поливинилхлорида в хлорбензоле. Рассчитайте массу полученного перхлорвинила, объем хлор-газа (м3, н.у.) и число баллонов со сжиженным хлором, необходимым для обработки 200т 12%-го раствора ПВХ, содержащего 56 % связанного хлора (по массе). Полученный перхлорвинил содержит 0,72 масс, доли хлора. Плотность хлора 3,21 кг, м , плотность сжиженного хлора - 1500 кг/м3. Объем газового баллона 0,04 м3.
Скачать решение задачи 9.13 (Задачник Ровкина Ляпков) 200р
Задача 9.14 Вычислите массу фторопласта 4, которую теоретически можно получить полимеризацией тетрафторэтилена, содержащего 14,7 кг связанного фтора. Анализ образца фторопласта показал наличие в нем 0,033 масс, доли нефторсодержащих примесей.
Скачать решение задачи 9.14 (Задачник Ровкина Ляпков) 200р
Задача 9.15 Определите суточную производительность и интенсивность многотрубного реактора непрерывной варки целлюлозы, если в течение 1 ч он перерабатывает 80 м3 еловой щепы. Расходный коэффициент еловой древесины составляет 5 м3 на каждую тонну целлюлозы, а производственные потери 7 %. Реактор имеет 8 труб длиной 10м и диаметром 0,8 м каждая.
ПОЛИМЕРЫ Ровкина Ляпков 1 часть
Задача 0.0 Рассчитать загрузку сырья на одну операцию в реактор объемом 32 м3 при следующих исходных данных:
- рецептура загрузки периодического производства эмульсионного полистирола включает следующие компоненты (в м.ч.): Стирол - 100; вода - 250; едкий натр - 0,2; инициатор - 0,5; эмульгатор – 2; плотность стирола 906 кг/м3; коэффициент заполнения аппарата ф = 0,75.
Скачать решение задачи 0.0 (Задачник Ровкина Ляпков) 150р
Задача 0.1 Производительность установки полимеризации этилена при низком давлении равна 4700 кг полиэтилена в час. Определить объемный расход этилена и полезный реакционный объем, если степень конверсии этилена равна 97 %, массовая концентрация полимера в суспензии, выходящей из реактора, 78 кг/м3, а время пребывания реакционной массы в реакторе 5 ч.
Скачать решение задачи 0.1 (Задачник Ровкина Ляпков) 150р
Задача 0.2 Составить материальный баланс установки производства полиэтилена под высоким давлением.
Исходные данные:
1. производительность по полиэтилену- 4000 т/год;
2. число часов работы установки в году - 7500;
3. потери этилена в расчете на свежий этилен, % (масса):
а) на компрессии 1 каскада П1 = 0,5;
б) на компрессии II каскада П2 = 4,5;
в) при обработке и других операциях П3 = 0,1;
4. концентрация этилена в техническом этилене х = 0,999;
5. концентрация кислорода хО2 = 0,005% (об);
6. конверсия этилена 0,18;
7. концентрация этилена в циркулирующем газе хц = 0,978.
Скачать решение задачи 0.2 (Задачник Ровкина Ляпков) 150р
Задача 1.1 Определите годовую производительность колонны синтеза аммиака в расчете на 100 %-й аммиак, если каждый час (на новых установках) вырабатывается 30 т 99 %-го аммиака.
Скачать решение задачи 1.1 (Задачник Ровкина Ляпков) 150р
Задача 1.2 Колонну для окисления твердого парафина загружают 40 т парафина, который занимает 75 % объема колонны (высота 10 м, диаметр 2,5 м). Процесс окисления длится в среднем 18 ч. Рассчитайте производительность колонны окисления парафина.
Задача 1.3 Необходимо определить плотность этилена при 150 МПа и 180 °С, пользуясь диаграммой коэффициента сжимаемости. Критические параметры для этилена равны 282,4 К и 5,03 МПа.
Задача 1.4 Рассчитайге теплоту, выделяющуюся при образовании 100 кг метанола из СО и N2. Энтальпия образования (в кДж кмоль) составляет: СО - 110583; Н2 - 0; метанола - 201456.
Скачать решение задачи 1.4 (Задачник Ровкина Ляпков) 150р
Задача 2.1 На установку полимеризации подают в час 4100 кг пропан-пропиленовой фракции с массовой долей пропилена 58 %. Степень конверсии пропилена 97 %. Выделяющуюся теплоту полимеризации (1395 кДж/кг полипропилена) снимают за счет испарения пропилена и части растворителя. Рассчитать количество растворителя, расходуемое на снятие выделяющейся теплоты, если теплота испарения пропана равна 11,4 кДж/моль, а теплота испарения растворителя равна 380кДж/кг.
Скачать решение задачи 2.1 (Задачник Ровкина Ляпков) 150р
Задача 2.2 Рассчитать массовый расход пропилена, гептана, водорода и катализаторного комплекса на выпуск 100000 т/год полипропилена. Установка работает 330 дней в непрерывном режиме. Конверсия пропилена 98 %. Подача водорода 3 % об. от подаваемого пропилена, гептан взят в объемном соотношении пропилентептан - 1,5:1, а микросферический катализатор из расчета 0,15-0,2 кг/м3.
Скачать решение задачи 2.2 (Задачник Ровкина Ляпков) 150р
Задача 2.3 Определить массовый расход этилена, пропана и кислорода для производства ПЭВД на установке с производительностью по полиэтилену - 75000 т/год в трубчатом реакторе, работающем по трехзонному варианту. Принять эффективное время работы установки равным 7800 ч. При решении задачи руководствоваться данными о составе потоков, представленных в табл. 2.3, и схемой материальных потоков на рис. 2.4.
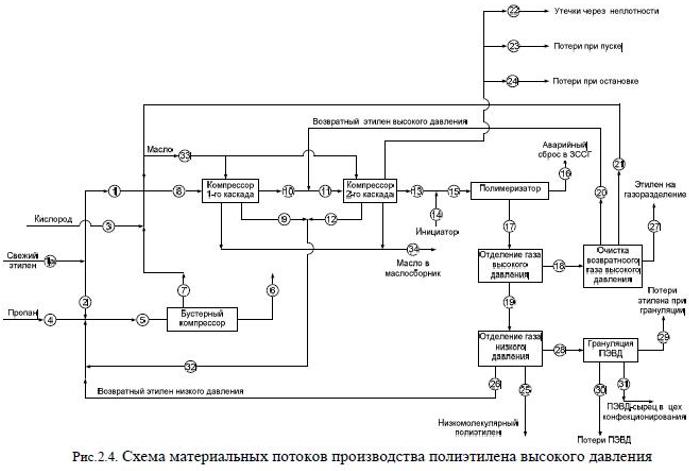
Скачать решение задачи 2.3 (Задачник Ровкина Ляпков) 150р
Задача 2.4 Используя условия задачи 2.3, рассчитать массовый расход реагентов в каждую из зон реактора и объемный расход реагентов в рабочих условиях.
Скачать решение задачи 2.4 (Задачник Ровкина Ляпков) 150р
Задача 2.5 Используя условия задачи 2.3, рассчитать расход перегретой воды для снятия теплоты, выделяющейся при полимеризации в каждой из трех зон.
Скачать решение задачи 2.5 (Задачник Ровкина Ляпков) 150р
Задача 3.1 Определить массовый расход реагентов в процессе получения 10000 т/год бутилкаучука. Процесс проводят в среде метилхлорида. Содержание мономеров в растворе 25 % масс., а содержание изопрена 1,2 % от суммы мономеров. Содержание треххлористого алюминия в растворе 0,2 %. Процесс производства - непрерывный, эффективное время работы установки 325 дней (7800 ч). Конверсия изобутилена составляет 97 %, конверсию изопрена принять равной 100 %.
Скачать решение задачи 3.1 (Задачник Ровкина Ляпков) 150р
Задача 3.2 Рассчитайте расход соли NаСl и 98%-й серной кислоты на 1 т каучука, который выделяется при коагуляции латекса СКС-30, если содержание полимера в нем 60 % (масс.). Коагуляцию проводят насыщенным раствором КаС1 и 5%-м раствором серной кислоты. Лабораторный анализ показал, что на 10 г латекса требуется 2,69 г NаСl и 5,38 мл 5%-го раствора серной кислоты.
Скачать решение задачи 3.2 (Задачник Ровкина Ляпков) 150р
Задача 3.3 Составьте формулу для расчета и определите коэффициент вулканизации (kв) мягкой резины, если образец вулканизата массой 250 г содержит 3 г связанной серы (5СВ), а содержание каучука (А) в вулканизате 60 % (масс.).
Скачать решение задачи 3.3 (Задачник Ровкина Ляпков) 150р
Задача 4.2 Массовая доля поливинилацетата в ПВА-эмульсии 50 %. Степень конверсии мономера 98,5%, производительность установки 1800кг полимера в час. Определить объемное соотношение ВА и водной фазы, если плотность ПВА-эмульсии 1025 кг/м3, а плотность винилацетата 934 кг/м3.
Cтраница 1 из 15


