Индивидуальные задачи по охт
Решение задач по ОХТ для экзамена, индивидульные задачи и решения
Задачи по ОХТ (онлайн) решения часть 1
Задача И-1 Составить материальный баланс обжига сульфатсодержащего сырья (ангидрита) в присутствии антрацита в производстве серной кислоты 2CaSO4 + С = 2СаО + СO2 + 2SO2. Производительность установки по моногидрату П т/год =140000 . Количество рабочих дней в году n=347 . Исходное сырье содержит C1 =87,8% масс. CaSO4, количество влаги С2=1,2 % масс. Антрацит содержит углерода С3=90,8 % масс. Избыток антрацита против стехиометрического 17 %. Весь избыточный углерод отеляется до СO2. Избыток воздуха а=2,1.
Скачать решение задачи И-1 (цена 100р)
Задача И-2 Подали на реакцию 15 г вещества А. Из них прореагировало 10г. В результате реакции образовалось 4 г. вещества С
3А → 2C + D
М(А) = 12 г/моль, М(С) = 15 г/моль
Найти конверсию х и селективность .
Скачать решение задачи И-2 (цена 100р)
Задача И-3 Выход фенола при кумольном способе получения составляет 70%. Селективность процесса 0,85. сколько можно получить фенола из 1т кумола.
Скачать решение задачи И-3 (цена 100р)
Задача И-4 Рассчитать расходные коэффициенты по этанолу и НВr на 1 т бромоэтана, если селективность процесса по этанолу составляет 85% (по массе), а по НВr – 92% (по массе). Потери этанола – 5% (по массе), НВr – 15% (по массе):
С2Н5ОН+ НВr = С2Н5Вr + Н2О
Скачать решение задачи И-4 (цена 100р)
Задача И-5 Рассчитать состав реакционной смеси для реакции окисления метана
CH4 + 2O2 = CO2 + 2H2O
Сырье: 1) 520 кг технического метана, состав (%мольн): CH4 – 65%, C2H6 – 20%, C3H8 – 15% 2)воздух. Молярное соотношение реагентов (CH4 : O2) составляет 1:2, конверсия метана a(CH4) = 0,55.
Скачать решение задачи И-5 (цена 100р)
Задача И-6 Получить 1 тонну 98 % раствора азотной ксилоты. Рассчитать расходные коэффициенты: 1)аммиака, содержащегося 99,5% об. 2) воздуха (кислорода) 3)воды
4NH3 + 5O2 = 4NO + 6H2O
2NO + O2 = 2NO2
2NO2 = N2O4
2N2O4 + O2 + 2H2O = 4HNO3
Скачать решение задачи И-6 (цена 100р)
Задача И-7 В реактор подается 200кмоль H2S воздушной смеси, содежащей 10%масс. H2S. Рассчитать исходную смесь.
Скачать решение задачи И-7 (цена 100р)
Задача И-8 Составить материальный баланс получения 1 м3 ацетилена из технического карбида кальция, содержащего 90% CaC2, если степень превращения карбида кальция составляет 0,94:
CaC2 + 2H2O = Ca(OH)2 + C2H2
Скачать решение задачи И-8 (цена 100р)
Задача И-9 Дымовые газы на выходе из топки содержат CO2 - 16% и O2 - 3%. После пылеулавливающих аппаратов содержание кислорода увеличилось в 2 раза. Определить подсос воздуха и содержание CO2 в газе после подсоса.
Скачать решение задачи И-9 (цена 100р)
Задача И-10-0 В реактор подается 200 кмоль H2S воздушной смеси, содежащей 10%мольн. H2S. Конверсия H2S - 85%. Определить концентрации компонентов реакционной смеси в различных единицах.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-0 (цена 100р)
Задача И-10-1 В реактор подается 500кг технического сероводорода (90% об. H2S и 10%об H2O), и 2500м3 воздуха. Конверсия H2S - 40%. Определить концентрации компонентов реакционной смеси в различных единицах.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-1 (цена 100р)
Задача И-10-2 В реактор подается 20 кмоль технического сероводорода, содержащего 3% масс H2 в качестве примеси и 200кмоль воздуха. Конверсия H2S - 81%. Определить концентрации компонентов реакционной смеси в различных единицах.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-2 (цена 100р)
Задача И-10-3 В реактор подается 400м сероводорода, содержащего 12%мольн. SO2 в качестве примеси и 50кмоль кислорода технического, содержащего 5%масс. азота. Конверсия H2S - 86%. Определить концентрации компонентов реакционной смеси в различных единицах.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-3 (цена 100р)
Задача И-10-4 В реакторе протекает реакция окисления сероводорода
H2S + 1,5O2 = SO2 + H2O
Рассчитать количество загружаемых в реактор веществ (в кмоль), если в реактор подается: 200 м3 смеси, содержащей H2S и H2O в массовом соотношении 10:1, и 2900 м3 воздуха. Рассчитать состав реакционной смеси (в кмоль, кг, %масс, %мольн, %об, кмоль/м3), если конверсия H2S =99%.
Скачать решение задачи И-10-4 (цена 100р)
Задача И-10-5 В реактор подается 500кг H2S воздушной смеси, содежащей 20%масс. H2S. Конверсия H2S - 40%. Определить концентрации компонентов реакционной смеси в различных единицах.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-5 (цена 100р)
Задача И-10-6 В реактор подается 5000м3 H2S воздушной смеси, содержащей 10% об. H2S. Рассчитать реакционную смесь, если конверсия сероводорода составляет 60%.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-6 (цена 100р)
Задача И-10-7 В реактор подается 500 м3 H2S воздушной смеси, содержащей 5% об. H2S. Рассчитать реакционную смесь, если конверсия сероводорода составляет 60%.
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-7 (цена 100р)
Задача И-10-8 В реакторе протекает реакция окисления сероводорода
2H2S + 3O2 = 2SO2 + 2H2O
В реактор поступает 20 м3 и 150 м3 воздуха состава: O2-27%, N2-79%. Конверсия =97%. Рассчитать состав реакционной смеси и выразить его в кмоль, кг, %масс, %мольн, %об, кмоль/м3. Определить конверсию кислорода.
Скачать решение задачи И-10-8 (цена 100р)
Задача И-10-9 В реактор подается 1000кг сероводорода, содержащего 12 %моль. SO2 в качестве примеси, и 2700 м3 воздуха. Конверсия H2S = 53%. Определить концентрацию компонентов реакционной смеси, выразив ее в %масс., %моль,.%об., кмоль/м3:
H2S + 1,5O2 = SO2 + H2O
Скачать решение задачи И-10-9 (цена 100р)
Задача И-10-10 В реакторе протекает реакция окисления сероводорода
H2S + 1,5O2 = SO2 + H2O
Рассчитать количество загружаемых в реактор веществ (в кмоль), если в реактор подается 300 м3 сероводорода, содержащего 2% об. H2O в качестве примеси и 1200м3 кислород-азотной смеси с массовым соотношением компонентов O2:N2 = 10:1. Рассчитать состав реакционной смеси (в кмоль, кг, %масс, %мольн, %об, кмоль/м ), если конверсия H2S=99%.
Скачать решение задачи И-10-10 (цена 100р)
Задача И-11 В реакторе протекает реакция
2CH4 = C2H2 + 3H2
В реактор поступает 25м3 метансодержащего газа состава: CH4 - 98% об. C2H2 - 2%об. Конверсия CH4 - 90%. Определить состав реакционной смеси и выразить его в кг, %масс., кмолях, %моль, м3, %об., кмоль/м3
Скачать решение задачи И-11 (цена 100р)
Задача И-12 В реакторе протекает реакция
CO + 2H2 = CH3OH
В реактор поступает 200кг синтез-газа в мольном соотношении CO : H2 = 2 : 6. Конверсия СО=12%. Определить состав реакционной смеси и выразить его в кг, %масс., кмолях, %моль, м3, %об., кмоль/м3.
Скачать решение задачи И-12 (цена 100р)
Задача И-12-1 В реакторе протекает реакция
CO + 2H2 = CH2OH
В реактор поступает 120 м3 синтез-газа, взяты в стехиометрических количествах.
Конверсия СО=15%. Определить состав реакционной смеси и выразить его в кг, %масс., кмолях, %моль, м3, %об., кмоль/м3.
Скачать решение задачи И-12-1 (цена 100р)
Задача И-13 В реакторе протекает реакция
C4H8 = C4H6 + H2
В реактор поступает 520 м3 бутиленовой фракции состава; C4H8 - 99%об., C4H10 - 1%об. Конверсия C4H8 = 37%. Определить состав реакционной смеси и выразить его в кг, %масс., кмолях, %моль, м3, %об., кмоль/м3.
Скачать решение задачи И-13 (цена 100р)
Задача И-14 Рассчитать материальный баланс печи обжига колчедана производительностью по сырью 200 т/сутки. Содержание пирита в колчедане составляет 41%, влаги - 3%. Коэффициент избытка воздуха - 3,5, степень сжигания колчедана - 80%.
Скачать решение задачи И-14 (цена 100р)
Задача И-15 Составить материальный баланс пиролиза 1 т этан-пропановой фракции состава (мас.д,%): метан - 12; этан - 52; пропан - 29; пропилен - 1,5; бутан - 5,5, если степень превращения составляет (%): бутан в этилен - 96; этана в этилен - 60; пропана в этилен - 70; пропана в пропилен - 15; этилена в ацетилен - 3.
C4H10 → 2C2H4 + H2
C2H6 → C2H4 + H2
C3H8 → C2H4 + CH4
C3H8 → C3H6 + H2
C2H4 → C2H2 + H2
Скачать решение задачи И-15 (цена 100р)
Задача И-16 Составить материальный баланс производства 70т/сут - 95%-ной серной кислоты из серы. Степень окисления серы в SO2 - 75%, SO2 в SO3 - 90%, а степень абсорбции триоксида серы составляет 80%.
Скачать решение задачи И-16 (цена 100р)
Задача И-17 Составить материальный баланс получения 1 т C2H5OH прямой гидратацией этилена. Состав исходной парогазовой смеси в % об.: этилен - 60%, водяной пар - 40%. Степень гидратации этилена 5%.
Скачать решение задачи И-17 (цена 100р)
Задача И-18-0 Составить материальный баланс процесса получения NH4NO3 в нейтрализаторе с использованием тепла реакции NH3 – чистый; HNO3 – 52 %. Вытекает из нейтрализатора 78 % - NH4NO3; избыток NH3 – 0,3 %. Баланс составить на 1000 кг NH4NO3. В приходе NH3 + HNO3 + Н2О
В процессе получения NH4NO3 протекает следующая реакция:
HNO3 + NH3 → NH4NO3 + Q
Скачать решение задачи И-18-0 (цена 100р)
Задача И-18-1 Составить материальный баланс производства 2 т нитрата аммония (аммиачной селитры), если в производстве применяется 48%-ная азотная кислота и 100% -ный газообразный аммиак по реакции:
HNO3 + NH3 → NH4NO3
Потерями HNO3 и NH3 в процессе производстве пренебречь. Из нейтрализатора аммиачная селитра выходит в виде 60%-го раствора NH4NO3 в воде. Определить количество влаги (соковый пар), испарившейся в результате экзотермической реакции нейтрализации. Найти невязку баланса.
Скачать решение задачи И-18-1 (цена 100р)
Задача И-19 На обжиг 100кг известняка, содержащего 97% CaCO3, расходуется 10 кг кокса, содержащего 81% С. Найти содержание CO2 в газе при теоретическом расходе воздуха.
CaCO3 = CaO + CO2
C + O2 = CO2
Скачать решение задачи И-19 (цена 100р)
Задача И-20 (вар 11) Рассчитать материальный баланс процесса обжига хромитовой шихты, протекающего по следующей реакции
Cr2O3 + 2Na2CO3 + 1,5O2 → 2Na2CrO4 + 2CO2
Исходная руда содержит Cr2O3, 90 %масс. (остальное примеси). Степень окисления, 92 %. Расчет вести на 1000кг исходной руды и на 1000 кг хроматан натрия, 1000кг крбоната натрия.
Скачать решение задачи И-20 (цена 100р)
Задача И-21 (вар 4) Рассчитать материальный баланс процесса газификации твердого топлива
3C + H2O + O2 → 3CO + H2
Состав бурого угля, 70 %масс. Степень выгорания, 92 %. Для газификации используют атмосферный воздух, %об. Кислород – 21, азот - 79. Расчет вести на 1000кг угарного газа.
Скачать решение задачи И-21 (цена 100р)
Задача И-22 Массовая доля Fe2O3 в 10 т руды – 72%, а железа в концентрате – 70%. При этом потери железа при обогащении составили 1%. Найти массу концентрата, выход концентрата, степени извлечения и обогащения.
Скачать решение задачи И-22 (цена 100р)
Задача И-23 Рассчитать теоретический и фактический расходные коэффициенты: производства бензола парофазной дегидрогенизации циклогексана: Химическая схема процесса:
C6H12 → C6H6 + 3H2
C6H12 → CH3C5H9
В реактор подается 100кг/ч бензола. Степень превращения бензола равна 85%. Выход циклогексана равен 60%.
Скачать решение задачи И-23 (цена 100р)
Задача И-24 Составить материальный баланс производства оксида этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в % об.: этилен - 4, воздух - 96. Степень окисления этилена Х=0,51. Расчет вести на 1т оксида этилена.
2C2H4 + O2 → 2C2H4O
Скачать решение задачи И-24 (цена 100р)
Задача И-25 Контактный метод получения серной кислоты. Получить 98% H2SO4 из железного колчедана (45% S). Влажность колчедана 6%, серы в огарке 1%. Расчет вести на 1500кг готового продукта. Исходное сырье: SO2 - 14,5%, N2 -74%, O2 - 11,5%.
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
Скачать решение задачи И-25 (цена 100р)
Задача И-26 Получение сульфата натрия из межкристальных рассолов (метод плавление-выпаривание): Расчет вести на 1000кг готового продукта. Исходное сырье: обогащенные межкристальные рассолы (NaCl - 1%, Na2SO4 - 30%, MgCl2 - 0,7%, H2O - 68,3%). Конечный продукт: 88% - Na2SO4.
2NaCl + MgSO4 → MgCl2 + Na2SO4
Скачать решение задачи И-26 (цена 100р)
Задача И-27 При конверсии оксида углерода с водяным паром значение константы равновесия К равна 10. Определить равновесный состав газа, если в исходной смеси на 1 моль окиси углерода приходится 2 моль водяного пара.
Скачать решение задачи И-27 (цена 100р)
Задача И-28 Рассчитать расходные коэффициенты в производстве фенола и ацетона из изопропилбензола. Степень превращения исходного сырья составляет 78%, коэффициент избытка воздуха -2. Расчет вести на 1000кг фенола.
Скачать решение задачи И-28 (цена 100р)
Задача И-29 Рассчитать расходные коэффициенты по сере и воде в производстве 1000кг/ч 92,5% серной кислоты. Содержание диоксида серы в обжиговом газе равно 8% об. Степень окисления диоксида серы составляет 0,97. степень абсорбции триоксида серы равна 99,9%. Рассчитать также концентрацию диоксида серы и триоксида серы в выходящем газовом потоке.
Скачать решение задачи И-29 (цена 100р)
Задача И-30 Из газа, содержащего SO2 - 0,4 %, и SO3 - 0,03% получают раствор NaHSO3 из содового раствора с концентрацией 22,5%. Найти состав конечного раствора. Расчет вести на 100 кг содового раствора.
NaOH + SO2 → NaHSO3
Скачать решение задачи И-30 (цена 100р)
Задача И-31 При газофазном хлорировании 10000 кг метана образовалось 500м3 хлористого метила, селективность по которому составила 75%. Определить степень превращения метана.
Скачать решение задачи И-31 (цена 100р)
Задача И-32 Определить расход бурого угля (60% масс. долей углерода), водяного пара и воздуха для получения 1000 м3 генераторного газа, в состав которого входят %об: СО - 30, H2 - 18, N2 - 52. Процесс газификации протекает по реакциям:
C + H2O = CO + H2
2C + O2 = 2CO
Скачать решение задачи И-32 (цена 100р)
Задача И-33-0 (вар 2) Составить часовой материальный баланс сжигания колчедана в печи КС. Производительность печи 250 (т/сут).Концентрация (массовая доля, %) серы в колчедане - 50, влаги в колчедане – 2,0, серы в огарке – 0,70. Концентрация (объемная доля, %) SO2 в сухом печном газе 15, кислорода в сухом печном газе 1,56. Относительная влажность воздуха – 65.
Скачать решение задачи И-33-0 (цена 100р)
Задача И-33-1 (вар 9) Составить часовой материальный баланс сжигания колчедана в печи КС. Производительность печи 800 (т/сут).Концентрация (массовая доля, %) серы в колчедане - 44, влаги в колчедане – 3,0, серы в огарке – 0,55. Концентрация (объемная доля, %) SO2 в сухом печном газе 13,0, кислорода в сухом печном газе 4,14. Относительная влажность воздуха – 55.
Скачать решение задачи И-33-1 (цена 100р)
Задача И-33-2 Составить часовой материальный баланс сжигания колчедана в печи КС-450. Производительность печи 450 (т/сут).Концентрация (массовая доля, %) серы в колчедане - 43,влаги в колчедане – 3,5, серы в огарке – 0,80. Концентрация (объемная доля, %) SO2 в сухом печном газе 14,5, кислорода в сухом печном газе 2,5. Температура поступающего колчедана 16 С, поступающего воздуха-18 С , в печи -800 С .Относительная влажность воздуха – 55.
Скачать решение задачи И-33-2 (цена 100р)
Задача И-33-3 Составить часовой материальный баланс сжигания колчедана в печи КС-200( на 1 ч работы печи). Производительность печи 200 (т/сут).Концентрация (массовая доля, %) серы в колчедане - 43,влаги в колчедане – 4,0, серы в огарке – 0,70. Концентрация (объемная доля, %) SO2 в сухом печном газе 14, кислорода в сухом печном газе 3,0. Температура поступающего воздуха 20°С. Относительная влажность воздуха – 50.
Скачать решение задачи И-33-3 (цена 100р)
Задача И-33-7 Составить часовой материальный и тепловой баланс сжигания колчедана. Производительность - 1300 (кг/ч). Концентрация серы в колчедане - 38,влаги в колчедане – 3, серы в огарке – 1,0. Концентрация SO2 в газе 14,0, кислорода в газе 2,2. Температура воздуха-23 С , в КС -840 С. Влагосодержание воздуха – 20г/м . Потери тепла – 3,2%.
Скачать решение задачи И-33-7 (цена 100р)
Задача И-33-8 Составить материальный баланс сжигания колчедана в печи КС-450. Производительность печи по колчедану 450 т/сутки. Содержание серы в колчедане – 35 %. Содержание влаги в колчедане – 3,8. Содержание серы в огарке – 2. Содержание SO2 в сухом печном газе 12,7. Содержание кислорода в сухом печном газе 2,3. Температура поступающего воздуха - 23 С. Относительная влажность воздуха – 50%.
Скачать решение задачи И-33-8 (цена 100р)
Задача И-34 Требуется приготовить 15 тонн серной кислоты концентрацией 70% мас. H2SO4 из растворов, содержащих 95 и 58 %мас. H2SO4. Сколько нужно взять исходных компонентов?
Скачать решение задачи И-34 (цена 100р)
Задача И-35 Рассчитать теоретические и практические расходные коэффициенты сульфата натрия и водорода для получения одной тонны технического сульфида натрия (содержание Na2S 98%мас.) на побочные реакции расходуется 1%мас. Na2SO4 и 2% об. водорода от теоретически необходимого количества. Содержание Na2SO4 в техническом сульфате натрия 97% мас. Содержание водорода в сырье 98%об. Процесс можно описать уравнением реакции:
Na2SO4 + 4H2 → Na2S + 4H2O
Скачать решение задачи И-35 (цена 100р)
Задача И-36 Составить материальный баланс получения 1 т гидрокарбоната натрия
NaCl + CO2 + NH3 + H2O -> NaHCO3 + NH4Cl
Хлорид натрия поступает в виде насыщенного раствора (рассола) с концентрацией NaCl 290,5 г/л (плотность 1,2 г/см ). Диоксид углерода поступает в виде газа, содержащего (в %об.) 87 – CO2, 10,3 – N2, 2,7 – O2, степень превращения хлористого натрия 93%, углекислого газа - 91%.
Скачать решение задачи И-36 (цена 100р)
Задача И-37 Рассчитать материальный и тепловой балансы прокалки железного купороса (Fe2SO4*7H2O) на 1 час работы. На прокалку поступает 1,1 кг/с железного купороса с температурой 290К, окись железа выходит с температурой 700К, а газы – 580К. Тепло подводится за счет сжигания природного газа, содержащего (в об %) CH4 - 92, N2 - 8. Потери тепла в окружающую среду – 30% от прихода тепла.
2Fe2SO4*7H2O = Fe2O3 + SO2 + SO3 + 14H2O
Рассчитать сколько потребуется природного газа для осуществления процесса разложения, если природный газ сжигают согласно уравнению реакции:
CH4 + O2 = CO2 + 2H2O
Скачать решение задачи И-37 (цена 100р)
Задача И-38 Составить материальный баланс и найти количество подведенного тепла в процессе получения водорода путем конверсии метана водяным паром, описываемой реакциями:
СН + Н О = СО + 3Н – Qр (204,4 кДж) (1)
СО + Н О = СО + Н + Qр (36,6 кДж) (2)
Количество паров воды (в кмоль) поступает в 4 раз больше, чем метана, степень превращения метана X = 0,8, выход оксида углерода ФСО = 0,7. Расчёт вести на 10000 м3/ч водорода.
Скачать решение задачи И-38 (цена 100р)
Задача И-39 Какой объем воздуха при нормальных условиях необходим для сжигания 1 м3 природного газа, содержащего 80% метана, 8% кислорода, 4% азота, 4% оксида углерода, 4% диоксида углерода (проценты объемные).
Скачать решение задачи И-39 (цена 100р)
Задачи по ОХТ (онлайн) решения часть 2
Задача И-40 Монохлорирование бензола проводится при следующих условиях: F0 (C6H6) = 250 кмоль/ч, F0(Cl2) = 400 кмоль/ч, F(C6H5Cl) = 85 кмоль/ч. Рассчитать материальный баланс процесса и на его основе составить таблицу материального баланса.
C6H6 + Cl2 = C6H5Cl2 + HCl
Скачать решение задачи И-40 (цена 100р)
Задача И-41 Составить материальный баланс процесса малеинового ангидрида гетерогенно-каталитическом окислением бензола, протекающего при 700 К в соответствии со следующей схемой последовательно-параллельных реакций:
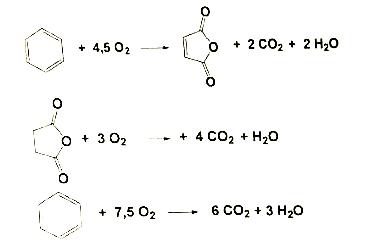
Определить селективность процесса в целевой продукт по бензолу, если выход целевого продукта х, процесс протекает при мольном потоке бензола, равном FA0=160кмоль/ч, начальном молярном соотношении O2:C6H6=21, до степени превращения бензола XА=93,5.
Скачать решение задачи И-41 (цена 100р)
Задача И-43 Производительность трубчатого четырехпоточного реактора 10 тонн пентена в час. Пентан поступает на пиролиз в смеси с водяным паром в мольном соотношении 5:1. Определить массовую скорость парогазовой смеси в трубах, если диаметр трубы змеевика 143 мм, а выход пентена 68 % в расчете на исходный пентан.
Скачать решение задачи И-43 (цена 100р)
Задача И-44 Рассчитать материальный и тепловой баланс трубчатой печи для конверсии природного газа. Состав природного газа, % объемные: CH4-97,8; C2H6-0,5; C3H8-0,2; C4H10-0,1; N2-1,4
-отношение пар-газ в исходной смеси 2,5;
-степень конверсии газа по углероду -67%;
Расчет ведем на 100 природного газа (при нормальных условиях).
Скачать решение задачи И-44 (цена 100р)
Задача И-45 Степень конверсии этилена в процессе его прямого окисления равна 45%; объем этилена, израсходованного в процессе, составляет 1800 м3. Определить селективность по этиленоксиду, если масса этиленоксида равна 690 кг.
Скачать решение задачи И-45 (цена 100р)
Задача И-46 Определить массу 64 м3 кислорода при температуре 165 С и давлении 0,25 МПа.
Скачать решение задачи И-46 (цена 100р)
Задача И-47 Вычислите константы равновесия Kp и Kc газовой реакции
CO + Cl2 = COCl2
состав газовой смеси при равновесии был следующим (% по объему):
CO=2,4; Cl2 = 12,6; COCl2 = 85;
а общее давление смеси при 20 C составляло 1,033 Па. вычислите G.
Скачать решение задачи И-47 (цена 100р)
Задача И-48 Составить материальный баланс производства 3,8 тонн криолита, если процесс описывается следующим суммарным уравнением:
2Al(OH)3 + 12HF + 3Na2CO3 = 2Na3AlF6 + 3CO2 + 9H2O или
2Al(OH)3 + 12HF = 2Н3AlF6 + 6H2O
2Н3AlF6 + 3Na2CO3 = 2Na3AlF6 + 3CO2 + 3H2O
Плавиковая кислота применяется в виде 17% раствора фтористого водорода в воде. Соду берут с 8% недостачи от стехиометрического соотношения для обеспечения необходимой остаточной кислотности.
Скачать решение задачи И-48 (цена 100р)
Задача И-49 Вычислите начальные концентрации веществ в обратимой реакции
2CO + O2 = 2CO2
и константу равновесия, если равновесные концентрации составляют
[CO]=0,44моль/л, [O2]=0,12моль/л, [CO2]=0,18моль/л,
Скачать решение задачи И-49 (цена 100р)
Задача И-50-1 Составить материальный баланс процесса гидродеалкилирования 1900кг толуола в бензол, протекающего в паровой фазе при температуре 1000К и давлении 5 МПа по следующей схеме последовательно-параллельных реакций:
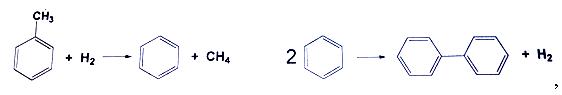
если процесс идет при 6-кратном мольном избытке водорода до степени превращения толуола 81%, с селективностью в целевой продукт по толуолу 95%.
Скачать решение задачи И-50-1 (цена 100р)
Задача И-50 Составить материальный баланс процесса гидродеалкилирования 1500кг толуола в бензол, протекающего в паровой фазе при температуре 100К и давлении 5 МПа по следующей схеме последовательно-параллельных реакций:
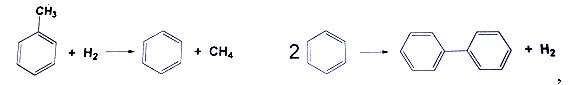
если процесс идет при 5,2-кратном мольном избытке водорода до степени превращения толуола 80,7%, с селективностью в целевой продукт по толуолу 95%.
Скачать решение задачи И-50 (цена 100р)
Задача И-51 Рассчитать материальный баланс следующего процесса:
Основная реакция CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Побочная реакция 2C2H5OH = C2H5OC2H5 + H2O
Вариант 6
Производительность реактора П = 7600 т/год
число дней работы реактора в году, n = 300
Технологический выход продукта ,f = 900%
Мольное соотношение исходных реагентов, А:В = 1:7
Степень превращения, XA = 85%
Селективность основной реакции, Ф = 96%
Состав исходного реагента А,% масс.
C2H5OH = 96
H2O (примесь) = 4
Состав исходного реагента В,% масс.
CH3COOH = 99
HCOOH = 1
Скачать решение задачи И-51 (цена 100р)
Задача И-52 Константа равновесия реакции
C2H6 = C2H4 + H2
при температуре 1100 К равна Кр = 1,67*10 Па. Энтальпия реакции -144451,4 Дж/моль. Определите равновесную степень превращения этана при температуре 1000 К и давлении р= 1,01*105 Па.
Скачать решение задачи И-52 (цена 100р)
Задача И-53 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. плотность раствора при условиях электролиза 1,17кг/л. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 1000 м3 хлора.
Скачать решение задачи И-53 (цена 100р)
Задача И-54 Определить расходные коэффициенты извести и кокса в производстве технического карбида кальция (ТКК), имеющего по анализу следующий состав (в %): CaC2 = А; СаО = Б; С = В; прочие примеси (ПП) = Г. Расчет вести на 1000 кг технического продукта. Содержание в коксе (в %): золы - Д, летучих компонентов (ЛК) - Е, влаги - Ж, углерода - И. Известь содержит К % чистого СаО. Карбид кальция получается по следующей реакции:
CaO + 3C CaC2 + CO.
Скачать решение задачи И-54 (цена 100р)
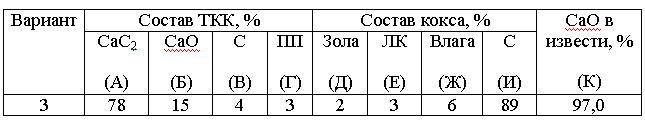
Задача И-54-1 Определить расходные коэффициенты извести и кокса в производстве технического карбида кальция (ТКК), имеющего по анализу следующий состав: СаС2 = А %, СаО = Б %, С = В %, прочие примеси (ПП) = Г %. Расчет вести на 1000 кг технического продукта. Содержание в коксе: золы – Д %, летучих компонентов (ЛК) – Е %, влаги – Ж %, углерода – И %. Известь содержит К % чистого СаО. Карбид кальция получается по следующей реакции СаО + 3С → СаС2 + СО. Варианты решения контрольного задания представлены в табл. 1
Скачать решение задачи И-54-1 (цена 100р)
Задача И-55 Материальный баланс приготовления пропиточного раствора
На приготовление сплава поступает 75 кг борной кислоты и 75 кг мочевины. Затем добавляется обессоленная вода до концентрации 10-14%:
(75+75)кг- сплав -10%
х кг –вода обес.-90%
Материальный баланс приготовления 1500кг пропиточного раствора
Материальный баланс приготовления 40тонн пропиточного раствора
Тепловой баланс приготовления пропиточного раствора
Скачать решение задачи И-55 (цена 100р)
Задача И-56 Определите состав реакционной смеси до и после реакции с учетом выхода продуктов реакции. Составьте таблицу материального баланса.
1 Химическая реакция для расчета материального баланса
FeCl3 + 3NaOH = Fe(OH)3 (осад) + 3NaCl
2 Характеристики исходных растворов
СМ (FeCl3) = 1 моль/л; Vр-ра (FeCl3) = 2л; p(FeCl3) = 1,08 г/мл;
Сн (NaOH) = 2 моль/л; Vр-ра (NaOH) = 3л; (NaOH) = 1,11 г/мл; a = 0,6.
Скачать решение задачи И-56 (цена 100р)
Задача И-57 Материальный и тепловой баланс
2СО + 4Н2 > С2Н4 + 2Н2О
СО – содержит 10% примеси СО2. Подается с избытком 1,1. Н2 – содержит 10% N2 и 5% NH3 Конверсия Н2 – 65%. Температуру реагентов применять 1000С. Расчет вести на 1т. С2Н4.
Схема движения материальных потоков
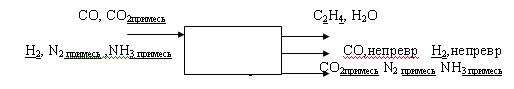
Скачать решение задачи И-57 (цена 100р)
Задача И-58 Составить материальный баланс обжига железного колчедана по реакции:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
на 100 кг/с FeS2. Состав колчедана: FeS2 – 90% масс., Fe2O3 – 10% масс. Коэффициент избытка воздуха по отношению к стехиометрическому – 2. Воздух абсолютно сухой.
Скачать решение задачи И-58 (цена 100р)
Задача И-59 Реакция протекает в присутствии катализатора с объемной скоростью Vоб=125 м3 (м3*ч). Диаметр реактора d=l,52 м, высота h = 3,05 м. Считая, что катализатор занимает 0,75 объема реактора, определить время контакта газа с катализатором и объем газовой смеси, проходящей через реактор в 1 ч.
Скачать решение задачи И-59 (цена 100р)
Задача И-60 Для получения этилового спирта способом прямой гидратации этилена в гидратор подали 16,5 моль этилена. Из них при Т=290°С и Р=7*106 Па гидратации подверглись 13,2 моль. Определите степень превращения этилена, начальный и конечный объемы газовой смеси при указанных условиях.
Скачать решение задачи И-60 (цена 100р)
Задача И-61 Определить количество аммиака, требуемого для производства 1000кг азотной кислоты с концентрацией 60% масс и расход воздуха на окисление аммиака, если выход оксида азота 0,97, степень абсорбции оксидов азота 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 9,5% (об.).
Молекулярная масса: NH3 - 17; HNO3 - 63.
Скачать решение задачи И-61 (цена 100р)
Задача И-61-1 Определить количество аммиака, требуемого для производства 100000 т/год азотной кислоты, и расход воздуха на окисление аммиака, если цех работает 355 дней в году, выход оксида азота 0,97, степень абсорбции 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 7,13% (масс.).
Молекулярная масса: NH3 - 17 ; HNO3 - 63.
Скачать решение задачи И-61-1 (цена 100р)
Задача И-62 Составить материальный баланс производства NH3. Степень превращения CaCN2 составляет 75%, а степень превращения в NH3 = 8,5%. Расчет вести на производительность 70т/сутки.
Скачать решение задачи И-62 (цена 100р)
Задача И-63 Определите количество угля, необходимое для обжига (при 700 С) 200 кг/сут магнезита след. состава: MgCO3 = 80% масс, SiO2 = 20% масс. Сколько при этом образуется дымовых газов? Процесс идущий в барабанной печи условно считать идущим без потерь сырья и тепла через стенки аппарата. Температура отходящих газов 200 С, продукта на выходе 100 С. Конверсия угля до CO2 принять 100%.
Скачать решение задачи И-63 (цена 100р)
Задача И-64 Составьте материальный баланс гидратации оксида магния при следующих данных. Соотношение исходных компонентов на реакцию 1:2, производительность гасителя 200 кг/сут по продукту. Исходный компонент имеет состав (%масс): МgO - 90 (активными из них являются 80%), МgCO - 5, SiO2 - 5. Температура в гасителе -100 C.
Скачать решение задачи И-64 (цена 100р)
Задача И-65 Составьте материальный баланс гидратации оксида магния острым паром с Т = 125 С при следующих данных. Соотношение исходных компонентов на реакцию 1:1,5, производительность гасителя по оксиду 100 тыс.т/год. Магнезит имеет состав (%масс): МgO-92 (активными из них являются 80%), SiO2 - 5, CaO - 3.
Скачать решение задачи И-65 (цена 100р)
Задача И-66 Составить материальный баланс производства 5т обычного стекла, если известняк содержит 10% примесей, сода используется следующего состава (%масс.): Nа2СО3 – 93%; NаНСО3 - 6%; другие примеси – 1%. Степень превращения соды и известняка 81% и 85% соответственно. Для расчета принимаем, что кварцевый песок без примесей. Сырьем для производства обычного стекла служит кварцевый песок, сода и известняк.
Скачать решение задачи И-66 (цена 100р)
Задача И-67 Определить интенсивность печи, т.е. количество колчедана (в пересчете на 45 %-ный), сжигаемого на 1 м2 пода печи в сутки, если площадь основного пода печи 16,7 м2. В печи КС-200 сгорает в 1 ч 10 т колчедана, содержащего 41% серы.
Скачать решение задачи И-67 (цена 100р)
Задача И-68 (вар 3) Составить материальный баланс печи для сжигания серы. Расчет вести на производительность печи по сжигаемой сере в кг/ч. Процесс горения описывается уравнением: S + O2 → SO2.
Производительность печи 60 т/сутки Степень окисления серы 0,95 Коэффициент избытка воздуха 1,3
Скачать решение задачи И-68 (цена 100р)
Задача И-68-1 Составить материальный баланс печи для сжигания серы производительностью 40 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,4. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-1 (цена 100р)
Задача И-68-2 Составить материальный баланс печи для сжигания серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,5. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-2 (цена 100р)
Задача И-68-3 Составить материальный баланс печи для сжигания серы производительностью 3 т/час. Степень окисления серы 0,98 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха 1,15. Расчет вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-3 (цена 100р)
Задача И-68-4 Составить материальный баланс (в кг/ч) печи для сжигания серы производительностью 7000 серного ангидрида. Степень превращения исходной серы составляет 95%, коэффициент избытка воздуха 4,7.
Скачать решение задачи И-68-4 (цена 100р)
Задача И-69 Определить выход продукта R и степень превращения реагента А, если обратимая реакция А ↔ 2R + S протекает до равновесия, когда хАр = 0,65. Соотношение концентраций продукта и реагента СR:СА = 2
Скачать решение задачи И-69 (цена 100р)
Задача И-70 Составить материальный баланс процесса получения железного купороса, если состав огарка Fe2O3 - 45% , FeO - 25% , FeS - 15% выход продукта 98%. Расчет вести на 1 тонну железного купороса.
DeO + H2SO4 = DeSO4 + H2O
Скачать решение задачи И-70 (цена 100р)
Задача И-71 В равновесной смеси, полученной в результате пиролиза метана при 1600С
2CH4 = C2H2 + 3H2
концентрация метана составляет 3 моль/л. Считая, что превращению подверглось только 25% исходного количества метана, определите константы равновесия и при указанной температуре.
Скачать решение задачи И-71 (цена 100р)
Задача И-72 Газофазная реакция A + 3B → 2R протекает при постоянном давлении. Исходные концентрации А и В равны соответственно 0,4; 0,5 молярной доли. В продуктах содержится 0,7 молярной доли продукта R. Определить концентрации других веществ и степень превращения В.
Скачать решение задачи И-72 (цена 100р)
Задача И-73 Производительность в печи сжигания мазута 8 тонн в час. Содержание S в мазуте 6%, твердый остаток 4%. Степень сгорания мазута до CO2 - 96%, до CO - 4%. Определить выбросы SO2, CO, CO2.Степень улавливания 0%. Ставить материальный баланс.
Скачать решение задачи И-73 (цена 100р)
Задача И-74 В реакторе протекает реакция:
C2H4 + H2O = C2H5OH
В реактор поступает 582кг исходной смеси реагентов в мольном соотношении H2O:C2H4 = 0,3:0,5. Конверсия этилена 5%.
Определить состав реакционной смеси и выразить его в кмоль, кг, %масс, %мольн, %об, кмоль/м3. Определить конверсию водяного пара.
Скачать решение задачи И-74 (цена 100р)
Задача И-75 Составить материальный баланс производства кальцинированной соды аммиачным пособом, который протекает по реакциям:
NaCl + NH3 + H2O + CO2 = NaHCO3 + NH4Cl
2NaHCO3 = Na2CO3 + CO2 + H2O
Производительность установки производства соды 100 тонн. Состав рассола, % (масс.): NaCl – 25; NH3 – 6,8; H2O – 68,2. Содержание углекислого газа, % (об.): CO2 – 68, N2 – 32. Потери CO2, % (масс.): 5. Конверсия CO2 - 65%.
Скачать решение задачи И-75 (цена 100р)
Задача И-76 Составьте материальный и тепловой баланс получения 980000т/год нитрата магния из порошка ПМК состава (%масс): оксид магния - 85%, карбонат магния - 10% песок кварцевый - 5%. Концентрация азотной кислоты - 63%. Принять потери на транспортировку и упаковку продукта в количестве 3% от производительности. Температура процесса 60 С.
Скачать решение задачи И-76 (цена 100р)
Задача И-77 Этилен получают путем пиролиза пропана:
C3H8 = C2H4 + CH4
В продуктах реакции содержится 1,0% об% пропана.
Рассчитать степень превращения пропана, выход этилена и расходный коэффициент по сырью в кг и м3. Расчет провести на 4 тонн этилена.
Скачать решение задачи И-77 (цена 100р)
Задача И-78 Составить материальный баланс процесса получения поташа (карбоната калия), если исходный раствор содержит 154г/л KOH и 180г/л KCl. Топочный газ, на карбонизацию содежит CO2 – 10% . Степень карбонизации едкого калия 90%. Выход продукта K2CO3 = 98% и KCl = 1% . Расчет вести на 1000кг карбоната калия.
Скачать решение задачи И-78 (цена 100р)
Задача И-79 Определите количество активного оксида магния образующееся при непрерывном разложении 20000 т/год магнезита следующего состава (%масс.): карбонат магния - 83, гидроксид магния - 7, доломит - 10. Составьте таблицу материального баланса. Какое количество теплоты необходимо затратить на разложение этого минерала?
Скачать решение задачи И-79 (цена 100р)
Задача И-80 Рассчитать материальный баланс производства серной кислоты методом сжигания сероводорода производительностью 20 т/час, если известен состав исходного сырья:
H2S = 90%, H2O = 5%, N2 = 5%. Соотношение сероводород-воздух: 10 м3. Содержание влаги в воздухе составляет 1% .Производственные потери 5% .
Скачать решение задачи И-80 (цена 100р)
Задача И-81 Рассчитать материальный и тепловой баланс печи для сжигания сероводорода.
на сжигание подается газ следующего состава в расчете на сухой газ, % объемные: H2S = 91,3; SO2 = 5,5; H2 = 0,8; CH4 = 0,9; C2H6 = 0,5; C3H8 = 0,5; C4H10 = 0,5
газ поступает в количестве 2250 м3/час; коэффициент избытка воздуха равен 2,5; -относительная влажность воздуха 60%.
Скачать решение задачи И-81 (цена 100р)
Задача И-82 Определить степень превращения соды и выход продукта при получении известковым способом 10т 40%-ного раствора NaOH, если для производства взято 5,75т содового сырья, содержащего Na2CO3 = 95% и NaHCO3 = 5% .
Реакции процесса
Na2CO3 + CaO + H2O = 2NaOH + CaCO3
2NaHCO3 = Na2CO3 + CO2 + H2O
Скачать решение задачи И-82 (цена 100р)
Задача И-83 Составить материальный баланс процесса получения фосфатных солей из экстракционной фосфорной кислоты без её предварительной очистки, если: марганца: P2O5 - 52%, F - 0,4%, марганца - 0,35г/л, меди: 0,02г/л, ванадия: 0,12г/л. Выход фосфатных солей - 73%. Расчет вести на 1000кг солей.
2NH3 + H3PO4 = (NH4)2HPO4
Скачать решение задачи И-83 (цена 100р)
Задача И-84 Составить материальный баланс для 1000кг тетрабората натрия по уравнению:
NaBrO +F +2NaOH → NaBrO +2NaF+H2O, если:
NaBrO -63%;
NaOH-40%.
Скачать решение задачи И-84 (цена 100р)
Задача И-85 Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга [30% (об.) пропилена и 70% (об.) пропана] для производства 1 т фенола, если выход изопропилбензола из бензола составляет 90% от теоретического, а фенола из изоропилбензола - 93%.
Скачать решение задачи И-85 (цена 100р)
Задача И-86 Определить расходные коэффициенты в производстве карбида кальция (технического), содержащего [% (масс.)]: CaC2 -78; CaO - 15; C - 3; прочие примеси- 4. Известь содержит 96,5% CaO. Содержание (%) в коксе: золы - 4, летучих - 4, влаги- 3. Расчёт вести на 1 т технического продукта. Молекулярная масса: CaC2 - 64, CaO - 56.
Скачать решение задачи И-86 (цена 100р)
Задача И-87 Рассчитать расходный коэффициент природного газа, содержащего 97% (об.) метана, в производстве уксусной кислоты (на 1 т) из ацетальдегида. Выход ацетилена из метана составляет 15% от теоретически возможного, ацетальдегида из ацетилена - 60%, а уксусной кислоты из ацетальдегида - 90% (масс.).
Скачать решение задачи И-87 (цена 100р)
Задача И-88 Составить материальный баланс производства оксида этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %об.: этилен - 2,5, воздух - 97,5. Степень окисления этилена Х=0,6. Расчет вести на 1,5т оксида этилена. Для расчета принять состав воздуха [%об.]: .
Окисление этилена происходит по реакции:
2CH4 + O2 = 2C2H4O
Скачать решение задачи И-88 (цена 100р)
Задача И-88-1 Составить материальный баланс производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %(об): этилен – 3, воздух – 97. Степень окисления этилена Х = 0,6. Расчет вести на 2000 кг оксида этилена.
Производство оксида этилена происходит по следующей схеме:
2CH2=CH2 + O2 → 2(CH2-CH2)O
Скачать решение задачи И-88-1 (цена 100р)
Задача И-89 При крекинге бутана объемом 3.36 л образуются этан и этилен. Рассчитайте массу бромной воды, которые могут обесцветить продукты крекинга.
Скачать решение задачи И-89 (цена 100р)
Задача И-90 Восстановление олова из минерала касситерита происходит по схеме 2SnO2 + 3C = 2Sn + 2CO + CO2. Сколько касситерита содержащий 76% SnO2 и кокса, который содержит 87% углерода, нужно для выплавки 1 т черного олова, содержащий 90% чистого олова.
Скачать решение задачи И-90 (цена 100р)
Задачи по ОХТ (онлайн) решения часть 3
Задача И-91 Производительность реактора газофазной гидратации этилена равна 15000 кг этанола в час. Определить тепловой эффект реакции и массовый расход водного конденсата, подаваемого в межтрубное пространство реактора для снятия выделяющегося тепла за счет испарения воды. Теплота парообразования воды равна 2262 кДж/кг. Теплоты образования реагентов и продуктов реакции:
Н0обр.(С2Н4) = 52,3 кДж/моль, Н0обр.(Н2О) = -241,84 кДж/моль, Н0обр.(С2Н5ОН) = - 234,8 кДж/моль.
Скачать решение задачи И-91 (цена 100р)
Задача И-92 Для алкилирования бензола используют бутан-бутиленовую фракцию, объемная доля бутена в которой равна 0,5. Определить объем алкилирующей фракции, необходимый для получения 2000 кг втор-бутилбензола, если селективность по втор-бутилбензолу составляет 90%.
Скачать решение задачи И-92 (цена 100р)
Задача И-93 Выход фенола при кумольном способе получения составляет 70%. Селективность процесса 0,8. Сколько можно получить фенола из 1 т кумола.
Реакция получения фенола кумольным способом:
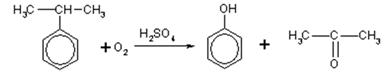
Скачать решение задачи И-93 (цена 100р)
Задача И-94 На получение 200 кг полипропилена при высоком давлении израсходовано 500 м3 пропилена. Определить степень конверсии пропилена.
Формула получения полипропилена при высоком давлении
Н2С=СН-СН3 = Н2С=СН-СН3
Скачать решение задачи И-94 (цена 100р)
Задача И-95 Тепловой эффект процесса получения трихлорметана газофазным хлорированием метана равен 309 кДж/моль; площадь поверхности змеевиков для снятия реакционной теплоты 35 м2; коэффициент теплопередачи 92 Вт/м2•К; средний температурный напор 125 К. Определить часовую производительность реактора по трихлорметану.
Скачать решение задачи И-95 (цена 100р)
Задача И-96 Определить объем пропилена, образующегося при пиролизе 1000 кг н-бутана, если степень конверсии н-бутана 90%, а селективность по пропилену 20%.
Пиролиз н-бутана до пропилена
C4H10 = C3H6 + CH4
Скачать решение задачи И-96 (цена 100р)
Задача И-97 При газофазном хлорировании 1000 м3 метана образовалось 500 кг метилхлорида, селективность по которому составила 52%. Определить степень конверсии метана.
Хлорирование метана протекает по реакции:
CH4 + Cl2 = CH3Cl + HCl
Скачать решение задачи И-97 (цена 100р)
Задача И-98 Определить число реакторов для получения винилхлорида, если на гидрохлорирование ацетилена поступает в час 475 м3 хлорводорода. Объем катализатора в каждом реакторе 6 м3, произво¬дительность 1 м3 катализатора составляет 50 кг винилхлорида в час, выход винилхлорида 90% по хлорводороду.
Уравнение реакции
C2H2 + HCl → CH2=CHCl
Скачать решение задачи И-98 (цена 100р)
Задача И-99 Определить плотность пропилена
а) при 450°С и 0,1 МПа
б) при 900°С и 0,2 МПа
в) при 1100°С и 0,4 МПа
Скачать решение задачи И-99 (цена 100р)
Задача И-100 Производительность реактора дегидрирования пропана составляет 15 т целевого продукта в час. Процесс проводят при 7500С, степень конверсии пропана равна 50 %, а селективность по пропилену составляет 65 %. Определить вместимость реактора, приняв для расчета константы скорости формулу: lgK/=15200/(4,575*T)-4,6
Скачать решение задачи И-100 (цена 100р)
Задача И-101 В результате прямой перегонки нефти получено в час 52000 кг бензиновой фракции (58-93 С), массовые доли компонентов в которой равны: парафины 4,9 %, непредельные 37,9 %, ароматические 56,2 %, нафтены 1 %. Определить компонентный состав фракции и массовый расход нефти, если выход фракции составляет 62 % от общего расхода нефти, поступающей на установку прямой перегонки.
Скачать решение задачи И-101 (цена 100р)
Задача И-102 Массовый расход этилбензола в реакторе получения стирола равен 10000 кг/ч, а объемная скорость подачи жидкого этилбензола равна 0,46 ч-1. Плотность бензола равна 867 кг/м3. Определить высоту слоя катализатора в реакторе диаметром 7,2 м.
Скачать решение задачи И-102 (цена 100р)
Задача И-103 В процессе дегидрирования н-бутенов степень конверсии сырья составляет 40%, а селективность по бутадиену равна 80%. Определить объем н-бутенов , необходимый для получения 50 кг бутадиена.
Скачать решение задачи И-103 (цена 100р)
Задача И-104 Формальдегид получают путем окисления метилового спирта в слое катализатора
2CH3OH + O2 = 2HCHO + 2H2O
В реактор производительность которого по целевому продукту равна 8300 кг/ч, поступает газовая смесь, объемная доля метилового спирта в которой 34%. При 560°С степень конверсии спирта составляет 74%, а селективность по формальдегиду равна 80%. Определить объем катализатора в реакторе приняв для расчета константы скорости такую формулу k = 2,8*105*e(-80000/RT)
Скачать решение задачи И-104 (цена 100р)
Задача И-105 Составить материальный баланс синтеза фенолоформальдегидного олигомера (ФФО) из фенола чистотой 98% и формалина (36% формальдегида в воде) на годовую производительность 1000тонн в год при конверсии по фенолу 90%. Молярное соотношение (загрузочное) фенол:формальдегид =5:7.
Скачать решение задачи И-105 (цена 100р)
Задача И-106 Объемный расход ацетальдегида, подаваемого на окисление, равен 6500 м3/ч, а объемная доля ацетальдегида в исходной паро-воздушной смеси равна 30%. Определить диаметр реактора, если линейная скорость смеси в сечении аппарата равна 0,18 м/с.
Скачать решение задачи И-106 (цена 100р)
Задача И-107 Алкилирование бензола пропиленом проводят в барботажном реакторе с внутренним диаметром 1,4 м. Производительность 1 м3 реакционного объема составляет 190 кг/час изопропилбензола, выход жидкого алкилата предусмотрен на высоте 8,5 м. Определить селективность процесса по изопропилбензолу, если степень конверсии бензола составляет 25 %, а его расход на входе в реактор равен 9200 кг/час.
Скачать решение задачи И-107 (цена 100р)
Задача И-108 В трубчатый реактор гидрирования со стадии гидроформилирования поступает 1350 кг/час 2-этилгексеналя. Гидрирование проводят в трубах, заполненных никелевым катализатором. Число труб 885, диаметр 55 мм, рабочая длина 3,8 м. Выделяющуюся теплоту отводят водой, циркулирующей в межтрубном пространстве. Определить средний температурный напор процесса теплообмена, если селективность по альдегиду равна 94,8 %, коэффициент теплопередачи 9 Вт/(м2•К), тепловой эффект гидрирования 1380 кДж на 1 кг образовавшегося спирта.
Скачать решение задачи И-108 (цена 100р)
Задача И-109 Степень конверсии этилена в процессе его прямого окисления равна 40%, объем этилена израсходованного в процессе составляет 2000 м3. Определить селективность по этиленоксиду, если масса этиленоксида равна 900 кг.
2C2H4 + O2 = 2C2H4O
Скачать решение задачи И-109 (цена 100р)
Задача И-110 Определить массу 20 м3 кислорода при температуре 150 С и давлении 0,3 МПа.
Скачать решение задачи И-110 (цена 100р)
Задача И-111 Производительность трубчатого четырехпоточного реактора 10 тонн пентена в час. Пентан поступает на пиролиз в смеси с водяным паром в мольном соотношении 4:1. Определить массовую скорость паро-газовой смеси в трубах, если диаметр трубы змеевика 70 мм, а выход пентена 60 % в расчете на исходный пентан
Скачать решение задачи И-111 (цена 100р)
Задача И-112 В процессе дегидрирования бутена степень конверсии сырья составляет 30%, а селективность по бутадиену равна 62%. Определить массу бутадиена, получаемого из 6800 м3 бутена.
Скачать решение задачи И-112 (цена 100р)
Задачи по ОХТ (онлайн) решения часть 4
Задача И-113 Вычислить теоретический расходный коэффициент для ацетилена и выход ацетальдегида при получении 1 т ацетальдегида, если степень превращения ацетилена 50 мас.д., выход в расчете на прореагировавший ацетилен 90 мас.д., практический расход ацетилена 680 кг на 1 т ацетальдегида.
C2H2 + H2O = CH3-CHO
Скачать решение задачи И-113 (цена 100р)
Задача И-114 Рассчитать расходные коэффициенты Zn и 98% Н2SО4 для получения гидроксида цинка, если степень превращения серной кислоты 79%, выход сульфата цинка 86% от теоретически возможного, а выход готового продукта 91% от теоретически возможного. Расчет вести на 597 кг гидроксида.
Скачать решение задачи И-114 (цена 100р)
Задача И-115 Определить объем оксида углерода(II), выделившегося при обжиге известняка, содержащего 10% примесей. Расход известняка 500 тонн. Степень превращения 86%.
CaCO3 → CaO + CO2
Скачать решение задачи И-115 (цена 100р)
Задача И-116 Составить материальный баланс производства 8т ацетилена из карбида кальция следующего состава (%масс.):
- СаС2 – 83%;
- СаО – 14%;
- С – 3%.
Степень превращения карбида кальция составляет 81%.
CaC2 + 2H2O → Ca(OH)2 + C2H2
Скачать решение задачи И-116 (цена 100р)
Задача И-117 Определить часовой расход ангидрита, содержащего 86,8% CaSO4 при переработке его в серную кислоту в цехе мощностью 150.000 т моногидрата в год. Количество рабочих дней в году 350, коэффициент использования серы во всем процессе – 90%.
Скачать решение задачи И-117 (цена 100р)
Задача И-118 Рассчитать расходные коэффициенты и массовый состав воздуха (О2 –21%, N2 – 79%) и аммиака следующего состава: NН3 – 17%, N2 – 11%, Н2 –72%, в производстве азотной кислоты, если в реакцию вступает 97% аммиака, выход NО составляет 77% от теоретически возможного, а выход готового продукта 17%. Расчет вести на 1572 кг азотной кислоты.
Скачать решение задачи И-118 (цена 100р)
Задача И-119 Определить расходный коэффициент раствора, содержащего 10% NаОН, необходимого для нейтрализации Н2SО4. Степень превращения щелочи 58%. Расчет вести на 7,3 тонн Nа2SO4.
Скачать решение задачи И-119 (цена 100р)
Задача И-120 Составить материальный баланс производства 5,5 т ацетилена из природного газа следующего состава (% об.):
– СН4 – 93%;
– С2Н6 – 4%;
– С3Н8 – 1%;
– N2 – 2%.
Степень превращения метана составляет 85%.
Скачать решение задачи И-120 (цена 100р)
Задача И-121 Определить количество моногидрата в сборнике. Вертикальный цилиндрический сборник диаметром 3 м заполнен на 1,5 м 92 %-ной серной кислотой. Плотность 92 %-ной кислоты при 20 °С 1824 кг/м3.
Скачать решение задачи И-121 (цена 100р)
Задача И-122 Рассчитать расход пирита, содержащего 78% FeS2, и воздуха (О2 – 21%, N2 – 79%) в производстве 540 кг серной кислоты. Выход SО2 15% от теоретически возможного, Степень превращения SО3 – 50%, а выход готового продукта 70% от теоретически возможного.
Скачать решение задачи И-122 (цена 100р)
Задача И-123 Определить расходный коэффициенты аммиака и азотной кислоты для получения 5 тонн нитрата аммония, если степень превращения аммиака составляет 49%, а выход готового продукта 74% от теоретически возможного.
HNO3 + NH3 → NH4NO3 + Q
Скачать решение задачи И-123 (цена 100р)
Задача И-124 Определить состав газа, получаемого при сжигании сероводородного газа, содержащего 85% H2S и 4% (об.) Н2О. Количество воздуха, подаваемого в горелку, равно десятикратному объему газа. Воздух содержит 1,5% (об.) Н2О.
Скачать решение задачи И-124 (цена 100р)
Задача И-125 Рассчитать расход водяного пара и природного газа, содержащего 76% метана, в производстве 1470 кг аммиака. Степень превращения СН4 – 81%, выход водорода составляет 70% от теоретически возможного, а выход готового продукта 81% от теоретически возможного.
Скачать решение задачи И-125 (цена 100р)
Задача И-126 Определить расходный коэффициент 10%-ной Н2SO4, необходимой для реакции нейтрализации NaOH. Степень превращения серной кислоты 71%. Расчет вести на 1 тонну Nа2SO4.
2NaOH + H2SO4 → 2H2O + Na2SO4
Скачать решение задачи И-126 (цена 100р)
Задача И-127 Составить материальный баланс реактора каталитического окисления метанола в формальдегид. Содержание метанола в спирто-воздушной смеси 15% об. Степень превращения метанола 70%. Расчет вести на 1,5 т готового продукта.
2CH3OH + O2 → 2HCHO + 2H2O
Скачать решение задачи И-127 (цена 100р)
Задача И-128 Подсчитать максимальное содержание двуокиси серы в обжиговом газе, полученном при сжигании колчедана, при условии, что весь кислород поступающего в печь воздуха расходуется на обжиг.
Скачать решение задачи И-128 (цена 100р)
Задача И-129 Рассчитать расходные коэффициенты воздуха (О2 –21%, N2 – 79%) и природного газа следующего состава: СН4 – 98%, N2 – 2%, в производстве метанола следующего состава: СН3ОН – 93%, Н2О – 6%, примеси 1%, если степень конверсии метана составляет 87%, выход метанола 15% от теоретически возможного.
NH4 + 0,5O2 → CH3OH
Скачать решение задачи И-129 (цена 100р)
Задача И-130 Рассчитать объёмный расход аммиака с объёмной долей основного вещества 99,9% для получения 15 т/ч азотной кислоты концентрацией 55%. Степень использования сырья 0,8.
Скачать решение задачи И-130 (цена 100р)
Задача И-131 Составить материальный баланс разложения фосфорита серной кислотой
Состав фосфорита,кг: Ca3(PO4)2 - 1400; CaF2 - 45; неразлагаемые примеси - 80; влага - 37%. Степень разложения фосфорита 88%. Концентрация серной кислоты, 73%.
Скачать решение задачи И-131 (цена 100р)
Задача И-132 Составить материальный баланс стадии алкилирования бензола этиленом на 1500кг чистого этилбензола, если выход этилбензола составляет 65%. Известно также, что в результате побочных реакции на каждую тонну этилбензола образуется 50кг диэтилбензола и 20 кг триэтилбензола. Реагенты берутся в стехиометрическом соотношении по реакции №1. Исходный бензол содержит 2%об этана, а этилен -5%об этана.
C6H6 + C2H4 → C6H5C2H5
C6H6 + 2C2H4 → C6H4(C2H5)2
C6H6 + 3C2H4 → C6H3(C2H5)3
Скачать решение задачи И-132 (цена 100р)
Задача И-133 Составить материальный баланс реактора алкилирования бензола этан-этиленовой фракцией состава: C2H4 -50%, C2H6 - 45%, C3H6 - 1%, C3H8 - 4%.
Производительность реактора 15т этилбензола в час. конверсия этилена-0,95, пропилена -0,98, селективность образования этилбензола (ЭБ) -0,9, изопропилбензола (ИПБ) – 0,85. Мольное соотношение C6H6/C2H4 = 3. Побочные реакции –образование диалкилбензолов (диэтилбензола (ДЭБ) и диизопропилбензола (ДИПБ)). Реагенты берутся в стехиометрическом соотношении по реакции №1. Исходный бензол содержит 2%об этана, а этилен -5%об этана.
C6H6 + C2H4 → C6H5C2H5
C6H6 + C3H6 → C6H5CH(CH3)2
C6H6 + 2C2H4 → C6H4(C2H5)2
C6H6 + 2C3H6 → C6H4(CH(CH3)2)2
Скачать решение задачи И-133 (цена 100р)
Задача И-134 Рассчитать расходные коэффициенты ацетилена и водородного газа следующего состава: Н – 96%; О – 0,91%; N – 3,09%, для получения 4 тонн бензола, если степень превращения ацетилена составляет 72%, выход этилена 61% от теоретически возможного, а выход готового продукта 73% от теоретически возможного.
Химическая схема процесса:
4C2H2 + H2 → C6H6 + C2H4
Скачать решение задачи И-134 (цена 100р)
Задача И-135 Рассчитать теплоту, выделяемую при протекании экзотермической реакции разложения 1 т апатитового концентрата. Коэффициент разложения 97%. Содержание фторапатита в апатитовом концентрате 98%. Энтальпия образования веществ, кДж/моль:
Ca5F(PO4)3 - 6828,7; H2SO4 - 839,5; H2O - 286,4; CaSO4*2H2O - 2022,6; H3PO4 - 1278,2; HF - 269,6.
Скачать решение задачи И-135 (цена 100р)
Задача И-136 Рассчитать материальный баланс реактора для приведенной выше реакции при следующих условиях: ПNH3 = 5кг/ч, XNH3 = 0,95; XN2 = 0,8; ф(N2)NH3 - 0,9; ф(H2)NH3 - 0,97.
Скачать решение задачи И-136 (цена 100р)
Задача И-137 Составить материальный баланс контактного узла окисления аммиака в производстве азотной кислоты. Количество окисляемого аммиака,1750 кг. Степень окисления аммиака до NO2 - 95,9%, од N2 - 4,1%. Содержание в аммиачно-воздушной смеси аммиака 12 %об
4NH3 + 5O2 ↔ 4NO + 6H2O
4NH3 + 3O2 ↔ 2N2 + 6H2O
Скачать решение задачи И-137 (цена 100р)
Задача И-138 Составить материальный баланс (в килограммах) окисления аммиака на 1 т аммиака, предполагая, что оксиление полное. 2% аммиака окисляется только до азота. Аммиачно-воздушная смесь с объемной долей аммиака 0,11.
Уравнение реакций:
4NH3 + 5O2 ↔ 4NO + 6H2O
4NH3 + 3O2 ↔ 2N2 + 6H2O
Скачать решение задачи И-138 (цена 100р)
Задача И-139 Составить уравнения материального баланса для ХТС конверсии метана водяным паром с целью получения стехиометрической азотно-водородной смеси для синтеза аммиака. Объем метана, подаваемого на конверсию V - 10000 м3, мольное соотношение метана и водяного пара 1:2.
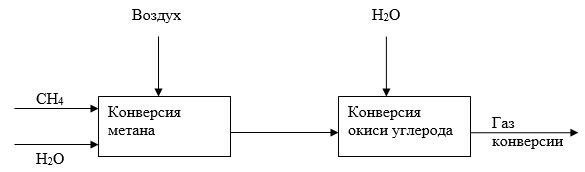
Скачать решение задачи И-139 (цена 100р)
Задача И-140 Производительность установки одностадийного дегидрирования н-бутана составляет 3400 кг бутидиена в час. Определить объем контактной массы, если объемная скорость паров н-бутана составляет 300 ч -1, объемное отношение катализатора и теплоносителя равно 1:2,4, степень конверсии н-бутана 30%, а селективностъ по бутадиену 55%.
Скачать решение задачи И-140 (цена 100р)
Задача И-141 Составить материальный баланс процесса паровой конверсии монооксида углерода (на 1000нм3 сухого концентрированного газа). Состав концентрированного газа
CO - 5%, CO2 - 17%, H2 - 58%, CH4 - 1%, N2 - 19% пар/газ - 0,7. Ост.конц. СО (СГ),0,5 %об.
Скачать решение задачи И-141 (цена 100р)
Задача И-142 Составить тепловой баланс по получению 1000 м3 Н2 конверсией метана в одну стадию при 1000 °С:
CH4(г) + H2O(п) = CO(щ) + 3H2(г), H>0
Скачать решение задачи И-142 (цена 100р)
Задача И-143 Рассчитать физическую теплоту газового потока в (МДж) на входе в конденсатор высокого давления. Поток имеет следующий состав, кг: СО2 - 62080; NH3 - 41605; Н2О - 3340; N2 - 1150; О2 - 224, и температуру 190 °С. Значения теплоемкостей рассчитать по эмпирическим формулам или взять из справочных таблиц.
Скачать решение задачи И-143 (цена 100р)
Задача И-144 Составить тепловой баланс сжигания серы в печи производительностью 3000 кг/ч по сере, степень окисления серы - 0,95. Коэффициент избытка воздуха 1,3. Температуры веществ, °С: сера - 140, воздух - 90. Потери тепла в окружающую среду составляют 10 % от прихода. Теплоемкость серы 1,037 кДж/(кг·К), теплоемкость воздуха 1,285 кДж/(м3·К). ΔНреак = -296,9 кДж/моль.
Скачать решение задачи И-144 (цена 100р)
Задача И-145 Определить равновесный состав (Па) газа при синтезе СН3ОН при соотношении Н2:СО 4,5:1 (в циркуляционном газе). Содержание инертных примесей - 13,8 %; давление 30 МПа, температура 365 °С. Температурная зависимость константы равновесия:
lgKp = lgPCH3OH*/(PCO**PH2*)-9,81*lgT - 0,00347*T+14,8
Скачать решение задачи И-145 (цена 100р)
Задача И-146 Рассчитать теплоту, выделяющуюся при сгорании 1 м3 топливного природного газа следующего состава: СН4 - 92; С2Н6 - 3; С3Н8 - 2; N2 - 3. Значения энтальпий образования веществ взять из справочных таблиц.
Скачать решение задачи И-146 (цена 100р)
Задача И-147 Составить тепловой баланс стадии контактирования при получении 1 т 100 %-ной НNО3. Содержание аммиака в АВС - 10,5 об. %. Степень контактного окисления - 97 %. Степень окисления NО - 100 %. Степень абсорбции - 98 %. Воздух насыщен парами воды при 30 °С. Относительная влажность - 80 %. Температура, °С: АВС - 405, НГ - 800. Теплота экзотермических реакций, кДж/кмоль: при окислении NН3 до NО - 918·103; при окислении NН3 до N2 - 1285*103.
Скачать решение задачи И-147 (цена 100р)
Задача И-148 Процесс окисления моноокида азота до диоксида азота сопровождается образованием димера N2О4. Рассчитать степень полимеризации NО2 для газовой смеси содержащей 5 об. % NО2 в исходном газе, если давление газа составляет 0,1 МПа, а температуры - 40 °С. Значение константы равновесия:
Kp=PNO2*2/PN2O4
Скачать решение задачи И-148 (цена 100р)
Задача И-149 При 727°С константа равновесия реакции 2SO3 = 2SO2 + O2 Kp = 2,93*104 Па. Под каким давлением степень диссоциации SO3 составит 20%

Скачать решение задачи И-149 (цена 100р)
Задача И-150 Для реакции 2HI = H2 + I2 при 360°С и 1,013•105 Па а = 20%. Определите, в каком направлении будет протекать процесс при следующих значениях парциальных давлений реагирующих веществ:
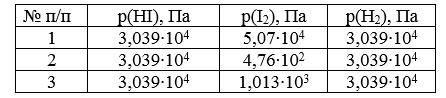
Скачать решение задачи И-150 (цена 100р)
Задача И-151 Рассчитать материальный баланс аммиачной селитры
Основное химическое уравнение :
NH3 + НNO3 → NH4NO3 + Q
Производительность установки по готовому продукту (100% NН4NО3) 2500 кг/ч/ Состав поступающего сырья, %масс
- азотная кислота - 60
- аммиак - 100
Содержание нитрата аммония в готовом продукте 99 %масс
Потери, %масс
- аммиака -0,5
- азотной кислоты - 0,5
Скачать решение задачи И-151 (цена 100р)
Задача И-151-1 Рассчитать материальный баланс аммиачной селитры
Основное химическое уравнение : NH3 + НNO3 → NH4NO3 + Q
Производительность установки
по готовому продукту (100% NН4NО3), 1000кг/ч
Состав поступающего сырья, %масс
- азотная кислота 48
- аммиак 97
Содержание нитрата аммония в готовом продукте, 66 %масс
Потери от выхода NН4NО3, %масс
- аммиака 0,3
- азотной кислоты 0,75
Скачать решение задачи И-151-1 (цена 100р)
Задача И-152 Составить материальный баланс для метилпреднизолона на 10 тонн. 6-a-метилкортизон подвергают микробиологическому дегидрированию по положению с получением метилпреднизолона:
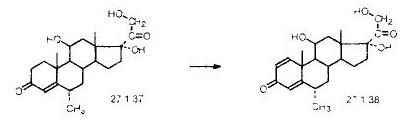
Запишем уравнение реакции следующим образом: C22H32O5 = C22H30O5 + H2
Скачать решение задачи И-152 (цена 100р)
Задача И-153 Материальный баланс производства тиамина (витамина В1)
Синтез тиамина из пиримидинового и тиазолового компонентов согласно реакции:
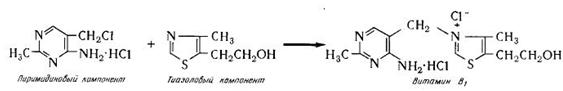
Производительность тиамина 10т=10000кг. Запишем реакцию по эмпирическим формулам компонентов:
C6H9N3Cl2 + C6H9OSN = C12H17N4OSCl2
Скачать решение задачи И-153 (цена 100р)
Задача И-154 Составить материальный баланс обжига железного колчедана (FeS2), содержащего различные примеси, включая 4,6% воды, если массовая доля серы в колчедане 42%. Считать, что обжиг ведут чистым кислородом с 10%-ным избытком от теоретического. расчет вести на 1 т колчедана, найти невязку баланса. Уравнение процесса:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Скачать решение задачи И-154 (цена 100р)
Задача И-155 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. плотность раствора при условиях электролиза 1,17кг/л. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 1000 м3 хлора
Скачать решение задачи И-155 (цена 100р)
Задача И-156 Рассчитать материальный баланс производства 15000т/ч 87%-ной серной кислоты из серного колчедана, содержащего 44% серы, при условии, что степень выгорания серы в колчедане составляет 99%, степень каталитического окисления диоксида серы -89,3%, а степень абсорбции триоксида серы -99,5%. Обжиговый газ содержит 12% диоксида серы. Воздух влажностью 50% перед подачей в печь для обжига колчедана подвергается осушке получаемой серной кислотой.
Скачать решение задачи И-156 (цена 100р)
Задача И-157 Рассчитать физическую теплоту 1 м3 топливного природного газа следующего состава, об. %: СН4 - 90; С2Н6 - 5; С3Н8 - 2,5; N2 - 2,5. Температура топливного природного газа равна 50 °С. Значения теплоемкостей рассчитать по эмпирическим формулам или взять из справочных величин.
Скачать решение задачи И-157 (цена 100р)
Задача И-158 В реактор окисления NН3 поступает АВС с расходом 60000 м3/ч (при н.у.), содержащая 10 об. %NН3. Селективность по NО составляет 0,95 при полном превращении NН3. Побочный продукт N2. Реакции:
4NH3 + 5O2 = 4NO + 6H2O; ΔН = -908 кДж (1)
4NH3 + 3O2 = 2N2 + 6H2O; ΔН = -1270 кДж (2)
Теплоемкости кДж/(моль·К): NH3 -38,5; O2 - 30,2; N2 - 29,2; NO - 31,9; H2O - 38,0. Температура в реакторе 1150 К. Потери тепла в окружающую среду составляют 10 % от прихода. Определить температуру на входе в реактор.
Скачать решение задачи И-158 (цена 100р)
Задача И-159 Газовая смесь, состава % объемных: СО - 20%, N2 - 80%, пропускается при температуре 1000 С и давлении 0,1 МПа над оксидом железа (II). В соответствии с реакцией:
FеО + СО = Fе + СO2.
Определить массу образовавшегося Fе на 1000 м3 исходного газа, состав равновесного газа, если константа равновесия равна 0,403.
Скачать решение задачи И-159 (цена 100р)
Задача И-160 Негашенная известь содержит 92% CaO, 3,5% CO2 и 4,5% примесей. Получается она обжигом известняка, содержащего 89% CaCO3*CO2 в негашенной извести получается из-за наличия в ней карбонатов, количество которых определяет степень обжига известняка. Определить расходный коэффициент известняка на 1 т извести указанного состава и степень обжига известняка (% массовые).
Скачать решение задачи И-160 (цена 100р)
Задача И-161 Составить материальный баланс и рассчитать выход при обжиге 1000кг руды, содержащей 22% массовых долей серы в виде сульфида цинка (остальное –несгораемые примеси) и при подаче полуторакратного избытка воздуха по отношению к стехиометрии. Реакция обжига
2ZnS + 3O2 = 2ZnO + 2SO2
В огарке содержится 0,5% массовых долей серы.
Скачать решение задачи И-161 (цена 100р)
Задача И-162 Составить материальный баланс синтеза фенолоформальдегидного олигомера (ФФО) из фенола чистотой 98% и формалина (36% формальдегида в воде) на годовую производительность 1000 тонн в год при конверсии по фенолу 90%. Молярное соотношение (загрузочное) фенол:формальдегид = 5:7.
Скачать решение задачи И-162 (цена 100р)
Задача И-163 Определить объем реакторов из расчета, что их будет 3 штуки, если время цикла процесса 9 часов. Эффективный фонд рабочего времени реактора составляет 7200 ч/год, плотность реакционной массы 1100 кг/м3, коэффициент заполнения реактора 0,75, коэффициент запаса мощности 1,1
Скачать решение задачи И-163 (цена 100р)
Задача И-164 Составить материальный баланс производства уксусной кислоты окислением ацетальдегида кислородом воздуха и рассчитать технологические показатели производства. Процесс окисления ацетальдегида в уксусную кислоту осуществляется в аппарате колонного типа при температуре 75С в присутствии солей и металлов переменной валентности, при этом протекают следующие реакции:
CH3-CHO + 0,5O2 → CH3-CHOOH
3CH3-CHO + 3O2 → 2CH3-CHOOH + HCOOH + H2O + CO2
2CH3-CHO + 5O2 → 4H2O + 4CO2
Составим систему уравнений:
A + 0,5B = C
3A + 3B = T + C + M + K
2F + 5B = 4M + 4K
Производительность по ледяной кислоте 86,9% -ной концентрации 1700кг/ч.
Скачать решение задачи И-164 (цена 100р)
Задача И-165 Составить материальный баланс газификации 1 т кокса, идущей по реакциям:
C + H2O = CO + H2 - 131кДж
CO + H2O = CO2 + H2 + 42131 кДж
В коксе содержится 3масс% зольных примесей, массовое содержание пар: кокс = 1,5, степень превращения углерода в коксе -0,87, выход моноксида углерода в коксе -0,7. Найти также общее количество подведенной теплоты.
Скачать решение задачи И-165 (цена 100р)
Задача И-166 Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта.
уравнения реакций:
2NaCl + 0,5O2 = Na2O + Cl2
Na2O+ V2O5 = 2NaVO3.
Суммарная реакция:
2NaCl + 0,5O2 + V2O5 = 2NaVO3 + Cl2
Сырье: ванадиевый шлак, содержащий 0,13%(масс.) V2O5, а в реакцию вступает весь кислород, 70% всего хлорида натрия и 95% всего V2O5. Определить невязку баланса.
Скачать решение задачи И-166 (цена 100р)
Задача И-167 Рассчитать расходные коэффициенты и массовый состав воздуха (О2 –21%, N2 – 79%) и аммиака следующего состава: NН3– 17%, N2 – 11%, Н2 –72%, в производстве азотной кислоты, если в реакцию вступает 97% аммиака, выход NО составляет 77% от теоретически возможного, а выход готового продукта 17%. Расчет вести на 1572кг азотной кислоты.
Скачать решение задачи И-167 (цена 100р)
Задача И-168 Определить расходный коэффициент раствора, содержащего 10% NаОН, необходимого для нейтрализации Н2SО4. Степень превращения щелочи 58%. Расчет вести на 7,3 тонн Nа2SO4.
Скачать решение задачи И-168 (цена 100р)
Задача И-169 Составить материальный баланс производства 5,5т ацетилена из природного газа следующего состава (% об.):
СН4 – 93%; С2Н6 – 4%; С3Н8 – 1%; N2 – 2%.
Степень превращения метана составляет 85%.
Скачать решение задачи И-169 (цена 100р)
Задача И-170 Определить количество моногидрата в сборнике. Вертикальный цилиндрический сборник диаметром 3 м заполнен на 1,5 м 92 %-ной серной кислотой. Плотность 92 %-ной кислоты при 20 °С 1824 кг/м3.
Скачать решение задачи И-170 (цена 100р)
Задачи по ОХТ (онлайн) решения часть 5
Задача И-171 Аккумуляторную кислоту (концентрация H2SO4 92,5%).нужно разбавить водой до содержания в ней 38% H2SO4. Сколько нужно взять воды для получения 180 кг разбавленной кислоты?
Скачать решение задачи И-171 (цена 100р)
Задача И-172 Вычислить массу карбида кальция, которая необходима для получения 0,1 м сухого ацетилена (при нормальных условиях), если степень превращения карбида кальция составляет 91%:
CaC2 + 2H2O → Ca(OH)2 + C2H2
Скачать решение задачи И-172 (цена 100р)
Задача И-173 Вычислить выход бутиленов при дегидрировании н-бутана на пропущенное сырье и на прореагировавший н-бутан, если его пропущено 0,935 м3, степень превращения 47%, увеличение объема газа после контактирования составляет 1,82 об.д., %, и содержание бутиленов в контактном газе - 22 мас.д.,%.
CH3-CH2-CH2-CH3 → CH3-CH2=CH2 + H2
Скачать решение задачи И-173 (цена 100р)
Задача И-174 Определить выход огарка при обжиге колчедана, содержащего 47% серы, если в огарке содержится невыгоревшей серы 1%.
Скачать решение задачи И-174 (цена 100р)
Задача И-175 Рассчитайте выход продукта Р, если известно, что при проведении последовательных реакций
A+B=P+R
P+M=S+Z
получается 12 моль продукта Р, 4 моль продукта S, а для проведения реакций было взято по 20 моль реагентов А и В.
Скачать решение задачи И-175 (цена 100р)
Задача И-176 Подсчитать теоретическое количество воздуха, которое необходимо подать в печи для сжигания серы. Сырьем для производства серной кислоты служит сера 1-го сорта следующего состава: S – 99,6%; As – 0,01%; H2O – 0,2%; зола – 0,19 %. Обжиговый газ содержит 12% (об.) SO2.
Скачать решение задачи И-176 (цена 100р)
Задача И-177 Определить количество чугуна, содержащего 95% железа, который можно получить из железной руды (Fe2O3), если расход руды составляет 5 тонн, а степень превращения руды 61%.
Скачать решение задачи И-177 (цена 100р)
Задача И-178 Составить материальный баланс регенерации 1000 кг аммиака известковым молоком (250 кг СаО/м3). Известь подается с избытком 5 %. Рассчитать выход аммиака по извести.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Скачать решение задачи И-178 (цена 100р)
Задача И-179 Рассчитать материальный баланс производства 62,23% азотной кислоты при условии, что на синтез поступило аммиака массой 284кг, из которого получено азотной кислоты объемом 1,14м3. определить выход азотной кислоты плотностью 1,390 кг/м3.
Молекулярная масса: NH3 - 17; HNO3 - 63.
Скачать решение задачи И-179 (цена 100р)
Задача И-180 Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта. Сырье: ванадиевый шлак, содержащий 0,13%(масс.) V2O5, и воздух. Расход хлорида натрия для выделения NaVO3 составляет 0,15 массовой доли шлака.
2NaCl + 1,5O2 + V2O3 = 2NaVO3 + Cl2
Скачать решение задачи И-180 (цена 100р)
Задача И-181 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Если молярная концентрация NaCl в растворе 5,4моль/л. плотность раствора 1,16кг/дм3. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 100м хлора
Скачать решение задачи И-181 (цена 100р)
Задача И-182 Составить материальный баланс реактора и тепловой эффект реакции алкилирования бензола пропиленом в присутствии фосфорнокислого катализатора, если известно: производительность установки 60000 т/год по пропан-пропиленовой фракции, содержащей пропилен 30% мольн.; мольное соотношение бензола и пропилена на входе в реактор 3:1 глубина превращения пропилена Х = 94%.; содержание изопропилбензола в алкилате 88% масс. Температура реакции 500 К.
Уравнения процесса получения стирола:
C6H6 + C3H6 → C6H5CH(CH3)2 ИПБ
C6H6 + 2C3H6 → C6H4(CH(CH3)2)2 ДИПБ
Скачать решение задачи И-182 (цена 100р)
Задача И-183 СО содержит 8% примеси СО2. Подается с избытком 1,1 H2 содержит 10% N2 и 5% NH3. Конверсия H2 - 68%. Температуру реагентов применять 100 °С. Расчет вести на 2т этилена.
2CO + 4H2 ↔ C2H4 + 2H2O
Скачать решение задачи И-183 (цена 100р)
Задача И-184 Производительность агрегата 13 т/ч по HNO3 с концентрацией 57 мас. %. Содержание аммиака в АВС – 9,2 об. %. Степень окисления аммиака до NO – 98,5 %, до N2 – 1,5 %. Степень абсорбции оксидов азота – 97,5 %. Воздух, поступающий на приготовление АВС, имеет относительную влажность 75 % при температуре 21 °С. Температура нитрозных газов на выходе из аппарата равна 910 С. Потери тепла в окружающую среду – 3,4 % от прихода теплоты. Остальные данные, необходимые для расчета, литературные и цеховые.
Скачать решение задачи И-184 (цена 100р)
Задача И-185 Процесс получения синтез-газа ведут при объемном отношении пара к метану равным 4:1. Составьте материальный баланс установки производительностью 1000 м3 синтез-газа в сутки при 30% конверсии метана.
Скачать решение задачи И-185 (цена 100р)
Задача И-186 При проведении реакции этерификации степень конверсии кислоты составляет 80%. Составьте материальный баланс установки производительностью 100 кг этилацетата в сутки, если 5% спирта расходуется на образование простого эфира.
Скачать решение задачи И-186 (цена 100р)
Задача И-187 Рассчитать материальный баланс получения простого суперфосфата из фосфорита следующего состава, масс. %: Р2О5 - 28,0; СаО - 41,0; Fe2O3 - 1,5; Al2O3 -1,0; МgО - 2,5; СО2 - 2,0; F - 2,5. Норма расхода серной кислоты - 105 % от стехиометрического количества. Концентрация исходной серной кислоты составляет 92,5 %, разбавленной - 69 %. Коэффициент разложения в камерном суперфосфате равен 82 %, после дозревания на складе - 94 %. Расчет вести на 1000 кг фосфата. Определить расходные коэффициенты на 1 т продукта.
Скачать решение задачи И-187 (цена 100р)
Задача И-188 Составить материальный баланс солено-сульфатного производства 3,4т Na2SO4, если в производстве используется поваренная соль, содержащая 98,5% (масс.) – NaCl и купоросное масло, содержащее 7% (масс.) примесей.
Степень разложения соли и купоросного масла 91% и 85% соответственно.
2NaCl + H2SO4 → 2HCl + Na2SO4
Скачать решение задачи И-188 (цена 100р)
Задача И-189 Рассчитать материальный баланс реактора для получения 500 кг фреона-12 фторированием тетрахлорметана в жидкой фазе. Состав органических продуктов: фреон-12 –75 %; фреон-11– 8 %; фреон-13 – 17 %;
Степень конверсии фтороводорода –95%;
CCl4 + HF = CCl3F + HCl
CCl4 + 2HF = CCl2F2 + 2HCl
CCl4 + 3HF = CClF3 + 3HCl
Степень чистоты исходного тетрахлорметана – 98 %.
Скачать решение задачи И-189 (цена 100р)
Задача И-190 Составить материальный баланс процесса получения фтороводорода из 1 тонны плавикового шпата, содержащего (мас.%): CaF2 - 99,88; SiO2 - 0,12. Если степень превращения CaF2 - 95%, а для производства применяют 95%-ную серную кислоту:
CaF2 + H2SO4 → CaSO4 + 2HF
SiO2 + 6HF → H2SiF6 + 2H2O
Считать, что оксид кремния полностью прореагирововал с образующимся HF. Найти невязку баланса.
Скачать решение задачи И-190 (цена 100р)
Задача И-191 Составить материальный баланс производства хлорбензола по следующим исходным данным: в хлоратор поступает 3500 кг/ч бензола с массовой долей 99 мас.д.,%. Выход хлорбензола по бензолу составляет 24 мас.д.,%, а дихлорбензола – 1,2 мас.д.,% от теоретического; хлор берется в избытке 10 % по отношению к техническому бензолу. Выделившийся хлорид водорода абсорбируется водой с получением соляной кислоты с
массовой долей НCl - 27,5 %.
C6H6 + Cl2 = C6H5Cl + HCl
C6H6 + 2Cl2 = C6H4Cl2 + 2HCl
Скачать решение задачи И-191 (цена 100р)
Задача И-192 Составить материальный баланс процесса хлорирования толуола производительностью 10т/ч, если выход бензохлорида составляет по толуола – 70, бензальхлорида -5 и бензотрихлорида -2 от теоретического. Содержание толуола в техническом продукте – 99 мас.д%, хлора в тех. Хлоре- 98 мас.д. %, избыток хлора – 10%.
C6H5-CH3 + Cl2 → C6H5-CH2Cl + HCl
C6H5-CH3 + 2Cl2 → C6H5-CHCl2 + 2HCl
C6H5-CH3 + 3Cl2 → C6H5-CCl3 + 3HCl
Скачать решение задачи И-192 (цена 100р)
Задача И-193 Составить материальный баланс процесса газификации 1 т кокса, идущей по реакциям:
C + H2O = CO + H2 - 131кДж
CO + H2O = CO2 + H2 + 42кДж
В коксе содержится 5 масс. % зольных примесей, массовое соотношение пар : кокс = 1:8, степень превращения углерода в коксе - 0,88, выход монооксида углерода – 0,9. Найти также общее количество подведенной теплоты.
Скачать решение задачи И-193 (цена 100р)
Задача И-194 Составить материальный баланс химического реактора для проведения реакции:
H2O + C2H4O → HOCH2CH2OH
HOCH2CH2OH + C2H4O → HOCH2CH2OCH2CH2OH
Производительность 4 т. этиленгликоля в час;
конверсия оксида этилена 0.99;
селективность по этиленгликолю – 0.85;
отношение H2O/C2H2O в исходной смеси 15 (мольн.).
Представим процесс в виде 2-х параллельных реакций
Н2О+ C2H4О → НОСН2-CH2ОН (ЭГ)
Н2О+ 2C2H4О НОСН2О-CH2ОН (ДЭГ)
Скачать решение задачи И-194 (цена 100р)
Задача И-195 Для получения растворимого стекла сплавляют песок, содержащий 98 мас%, SiO2, и кальцинированную соду, содержащую 95% мас.% основоного вещества. Состав стекла соответствует формуле Na2O*nSiO2, где n = 4 – модуль растворимого стекла. В процессе спекания «а» = 1 % соды теряется. Рассчитать расходные коэффициенты по сырью на 1 т стекла.
Скачать решение задачи И-195 (цена 100р)
Задача И-196 Цианамид кальция получают по реакции:
CaC2 + N2 = CaCN2 + C.
На 1 т технического цианамида, содержащего 18% связанного азота, расходуется 342 м3 азота (в пересчёте на нормальные условия). Технический карбид содержит 60 % СаС2.
Рассчитать состав технического цианамида и расходные коэффициенты по сырью.
Скачать решение задачи И-196 (цена 100р)
Задача И-197 Рассчитайте объем синтез-газа (м3), необходимого для получения 1 т метанола 98%-ной чистоты, если в присутствии катализатора и при оптимальных условиях можно достичь 87% выхода метанола.
CO + 2H2 = CH3OH
Скачать решение задачи И-197 (цена 100р)
Задача И-198 Уксусноэтиловый эфир получают реакцией этерификацией. При взаимодействии этилового эфира с уксусной кислоты:
C2H5OH + CH3COOH = CH3COOC2H5 + H2O
В лабораторных условиях берется 125 см3 уксусной кислоты и 150 см3 этилового спирта.
Определить количество образовавшегося согласно реакции эфира, степень превращения спирта, если фактический выход целевого продукта составил 52%?
Плотность этанола при 20°C - 0,789 гр/см3.
Плотность уксусной кислоты при 20°C - 1,049 гр/см3.
Скачать решение задачи И-198 (цена 100р)
Задача И-199 Сколько тонн 98% Н2SО4 можно получить из 2,4 тонн пирита. Степень превращения пирита 71%.
Скачать решение задачи И-199 (цена 100р)
Задача И-200 Рассчитайте полную селективность, если при проведении последовательных реакций
A ↔ R + M (целевая реакция)
A ↔ S + N (побочная реакция)
получено 6 моль продукта R, 2,5 моль продукта S.
Скачать решение задачи И-200 (цена 100р)
Задача И-201 Вычислить теоретический расходный коэффициент для ацетилена и выход ацетальдегида при получении 1 т ацетальдегида, если степень превращения ацетилена 50 мас.д., выход в расчете на прореагировавший ацетилен 90 мас.д., практический расход ацетилена 680 кг на 1 т ацетальдегида.
C2H2 + H2O → CH3-CHO
Скачать решение задачи И-201 (цена 100р)
Задача И-202 Составить материальный баланс производства двойного суперфосфата из 1000 кг апатитового концентрата, содержащего 41,2% Р2О5, если в производстве применяют 72%-ную фосфорную кислоту. Найти невязку. Процесс протекает по схеме:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Скачать решение задачи И-202 (цена 100р)
Задача И-203 Составьте материальный баланс производства серной кислоты. Производственными потерями пренебречь. Расчет вести на 500кг серной кислоты. Состав газа, поступающего в контактный аппарат: 8% - SO2, 80% - N2, 12% - O2.
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Скачать решение задачи И-203 (цена 100р)
Задача И-204 Рассчитать расходные коэффициенты по метану и хлору на 1 т хлорометана, если селективность процесса по метану С1 = 0,85, а по хлору – С2 = 0,92. Потери метана в процессе производства хлорометана составляют 15% (по массе), а хлора – 8% (по массе):
СН4 + Сl2 → СН3Сl + НСl
Скачать решение задачи И-204 (цена 100р)
Задача И-205 Составить материальный баланс производства ортофосфорной кислоты из 5т ортофосфата кальция, содержащего 6% примесей. Степень превращения ортофосфата кальция 92%. В производстве используется 93%-ная серная кислота.
Уравнение реакции:
Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Скачать решение задачи И-205 (цена 100р)
Задача И-206 Рассчитать производительность печи пылевидного обжига колчедана, если ее диаметр 4,2 м, высота 8 м, а интенсивность 1000 кг/(м3*сут).
Скачать решение задачи И-206 (цена 100р)
Задача И-207 Негашенная известь содержит 92% - CaO, 3,5% - CO2 и 4,5% примесей. Получается она обжигом известняка, содержащего 89% - CaCO3. CO2 в негашенной извести получается из-за наличия в ней карбонатов, количество которых определяет степень обжига известняка. Определить расходный коэффициент известняка на 1 т извести указанного состава и степень обжига известняка (% массовые).
Скачать решение задачи И-207 (цена 100р)
Задача И-208 Рассчитать расходные коэффициенты воды и технического карбида кальция, содержащего СаС2 – 81%, СаО – 13%, С – 6%, в производстве 2 тонн ацетальдегида, если степень превращения СаС2 = 75%, выход ацетилена 71% от теоретически возможного, а выход ацетальдегида 69% от теоретически возможного.
CaC2 + 2H2O → Ca(OH)2 + C2H2
C2H2 + H2O → CH3CHO
Скачать решение задачи И-208 (цена 100р)
Задача И-208-1 Составить материальный баланс производства технического карбида кальция, содержащего (%масс.): СаС2 – 75%; СаО – 19%; С – 6%. Если в производстве используется известь, содержащая 92,7% СаО, и кокс
следующего состава (%масс.): зола – 5%; летучие соединения – 5%; влага – 5%. Расчет вести на 1т технического продукта.
CaO + 3C = CaC2 + CO
Скачать решение задачи И-208-1 (цена 100р)
Задача И-209 Рассчитать расходные коэффициенты Zn и 96% Н2SО4 для получения гидроксида цинка, если степень превращения серной кислоты 81%, выход сульфата цинка 73% от теоретически возможного, а выход готового продукта 69% от теоретически возможного. Расчет вести на 700 кг гидроксида.
Zn + H2SO4 = ZnSO4 + H2
ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4
Скачать решение задачи И-209 (цена 100р)
Задача И-210 Определить расход воздуха на сжигание 100 м3 газа, если известен коэффициент избытка воздуха a. Определить содержание водяного пара в продуктах горения в массовых процентах и мольных концентрациях, если соотношение кислорода и азота в исходном воздухе составляет по массе 1:3,76. Составить материальный баланс.
CH4 + 2O2 = CO2 + 2H2O
Скачать решение задачи И-210 (цена 100р)
Задача И-211 Определить расход оксида фосфора (V) и воды при получении 1т фосфорной кислоты, если степень превращения оксида составляет 63%, а выход готового продукта 79% от теоретически возможного.
P2O5 + 3H2O = 2H3PO4
Скачать решение задачи И-211 (цена 100р)
Задача И-212 Рассчитать расходные коэффициенты для бензола и этилена при получении 1 т стирола, если выход этилбензола 95% мас.д. стирола 90 мсас.д.%, считая на прореагировавший этилбензол, степень превращения которого 40%.
C6H6 + C2H4 → C6H5C2H5 → C6H5-CH=CH2
Скачать решение задачи И-212 (цена 100р)
Задача И-213 Рассчитать расходные коэффициенты по этилену и воде на 1 т этанола, если селективность по этилену составляет 87%, по воде – 95%. Потери этилена, воды на стадиях производства составляют 7 и 5 %, соответственно:
СН2 = СН2 + Н2О → СН3СН2ОН
Скачать решение задачи И-213 (цена 100р)
Задача И-214 Для проведения технологического процесса необходима подача теплоносителя с температурой 92 °С.Теплоноситель состоит из двух потоков. Первый поток имеет температуру 86 °С, второй поток имеет температуру 99 °С. Определить соотношение потоков, если теплоноситель имеет одинаковый состав.
Скачать решение задачи И-214 (цена 100р)
Задача И-215 Определить среднюю молекулярную массу нефтепродукта, имеющего плотность p420 = 0,8765
Скачать решение задачи И-215 (цена 100р)
Задача И-216 Определить степень превращения ХВ и состав реакционной смеси для реакции A + 2B = 2R+ R’, если ХА = 0,6; СА0 = 1кмоль/м , СВ0 =1,5 кмоль/м3.
Скачать решение задачи И-216 (цена 100р)
Задача И-217 Рассчитать степень превращения водорода и выход теоретического аммиака при синтезе аммиака, если через некоторый момент времени в газовой смеси обнаружено 80 молей водорода и 20 молей аммиака. Процесс ведут при температуре 500 °С и давление 30 МПа. В этих условиях при состоянии равновесия в газовой смеси содержится 26,4% аммиака.
Скачать решение задачи И-217 (цена 100р)
Задача И-218 В резинотехнической промышленности для производства красок используют сажу, которую получают разложением природного газа, условно – метана: CH4 → C + 2H2. Из 1000 м3 метана (н.у.) получено 500 кг сажи. Производственные потери составили:
а) 6,7%; б) 7,2%; в) 8,6%; г) 9,7%.
Скачать решение задачи И-218 (цена 100р)
Задача И-219 Рассчитать материальный баланс производства фенола и ацетона кумольным способом
Пропускная способность по бензолу 150 т/сут
Конверсия бензола 0,95%
Конверсия кумола 0,95%
Конверсия ГПК 0,95 %
Скачать решение задачи И-219 (цена 100р)
Задача И-220 Рассчитать константу равновесия при температурах 434 и 2422 К для реакции A+B → R+S
если ΔG0434= -14 кДж/моль и ΔG02422= 29 кДж/моль
Скачать решение задачи И-220 (цена 100р)
Задача И-221 Рассчитать расходные коэффициенты по уксусной кислоте и PCl3 на 1 т ацетилхлорида, если селективность процесса по уксусной кислоте составляет 72% (по массе), а по PCl3 – 62% ( по массе). Потери уксусной кислоты – 10% (по массе), а PCl3 – 12% (по массе):
3СН3СООН + PCl3 → 3СН3СОСl + Н3РО3
Скачать решение задачи И-221 (цена 100р)
Задача И-222 Современная ТЭЦ сжигает 833 кг угля в сутки. Зольность угля – 15% масс., содержание серы – 2% масс. До диоксида углерода (СО2) сгорает 95% угля, до оксида углерода (СО) – 5%.
Определить:
1. Сколько выбрасывается золы, если степень её улавливания – 96%. Сколько образуется SO2, СО2, СО.
2. Составить материальный баланс процесса, результаты свести в таблицу.
Скачать решение задачи И-222 (цена 100р)
Задача И-223 Рассчитать внутренний диаметр вертикального гравитационного аппарата. Объемный расход газа в сепараторе составляет 10000 м3/сут, температура газа в сепараторе 20°С, давление газа в сепараторе 0,6 МПа. Скорость восходящего потока газа 0,1 м/с. Коэффициент сверхсжимаемости газа для условий первой ступени сепарации можно принять равным 0,95.
Скачать решение задачи И-223 (цена 100р)
Задача И-224 Составить материальный баланс реактора для проведения реакции:
CH3CH2CH2CH3 → C4H8 + H2
C4H8 → C4H6 + H2
Производительность реактора 10 т C4H8 в час;
конверсия н-бутана – 0.3; селективность по C4H8 – 0.75
Скачать решение задачи И-224 (цена 100р)
Задача И-225 Рассчитать материальный баланс производства анилина по реакции
основная C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
побочная 2C6H5-NO2 + 5H2 = C6H6 + N2 + 4H2O
Определить конверсию, селективность, расходные коэффициенты по сырью. Производительность установки 38,44 т/сут. Состав реакционной смеси (без учета воды), % мас. анилин – 78,4, нитробензол 5,2, бензол 16,4. Мольное соотношение нитробензол : водород 4,6. Содержание водорода в сырье (примесь N2) 97,2 %об. Потери анилина от полученного 0,3%
Скачать решение задачи И-225 (цена 100р)
Задача И-226 Составьте упрощенный материальный баланс производства этилового спирта прямой гидратацией этилена. Состав исходной парогазовой смеси (в % по объёму) : этилен – 60, водяной пар – 40. Степень гидратации этилена – 5%.Расчет вести на 1 т этилового спирта. Побочные реакции и давление не учитывать.. Получение этилового спирта прямой гидратацией этилена осуществляется при температуре 560К и давлении 80•105Па по реакции, протекающей по уравнению
CH2=CH2+H2O → C2H5OH + Qр
Скачать решение задачи И-226 (цена 100р)
Задача И-227 Составить материальный баланс реактора окисления метанола воздухом.
CH3OH + 1/2O2 → CH2O + H2O
CH2O +O2 → CO2 + H2O
Производительность – 3 т/час по CH2O, конверсия метанола – 0,9; селективность по CH2O – 0.8, отношение O2/CH3OH=1/1 (мол.).
Скачать решение задачи И-227 (цена 100р)
Задача И-228 Рассчитать расходные коэффициенты по толуолу и серной кислоте на 1 т n – толуолсульфокислоты, если селективность процесса по толуолу составляет 85%, а по серной кислоте – 95%. Потери толуола – 5%, а серной кислоты – 7%:
С6Н5–СН3 + Н2SО4 → Н3С–С6Н4–SО3Н + Н2О
Скачать решение задачи И-228 (цена 100р)
Задача И-229 Выполните расчет теплового баланса реактора окислительного дегидрирования метанола в формальдегид с целью уточнения температуры спиртовоздушной смеси на входе в реактор. Исходные данные: расход спиртовоздушной смеси - 0,10809 кмоль/с, количество контактного газа- 0,12573 кмоль/с, температура: на выходе 100-120 °С, на выходе из аппарата-680 °С
Скачать решение задачи И-229 (цена 100р)
Cтраница 1 из 2


