Раздел 2.2 до 2-5
Задача 2.2-1 Вывести уравнение для расчета равновесной степени превращения реагента А по известной Кс для реакции 2A ↔ R.
Скачать решение задачи 2.2-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-2 Вывести уравнение для расчета равновесной степени превращения реагента А в газофазной реакции по известным значениям константы равновесия Кр и давления Р в системе для реакции А+В ↔ R.
Скачать решение задачи 2.2-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-3 Вывести уравнение для расчета равновесного состава компонентов реакции синтеза аммиака по известным значения константы равновесия Кр и давления Р в системе.
Скачать решение задачи 2.2-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-5 Найти константы равновесия при температурах 500 и 2000 К для реакции
Н2О + СО ↔ Н2O + СО2,
если G500 = -20,2 и G2000 = 25,3 кДж/моль
Скачать решение задачи 2.2-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-7 Рассчитать константу равновесия синтеза хлористого водорода из водорода и хлора, если равновесная степень превращения по хлору равна 0,65. Синтез проводится под давлением 3*105 Па. Реакционная смесь взята в стехиометрическом соотношении.
Скачать решение задачи 2.2-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-9 Рассчитать константу равновесия и равновесные концентрации реакции восстановления диоксида углерода на графите, если степень превращения диоксида углерода равна 0,96. Процесс проводится под атмосферным давлением.
Скачать решение задачи 2.2-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-11 Рассчитать константу равновесия при температуре 573 К, равновесную степень превращения ХрА и равновесный состав смеси для реакции:
А + В = 2R,
Если Н0573 = -24,5 кДж/моль S0573 = - 58 кДж/(кмоль•град), СА0 = 2 кмоль/м3, СВ0 = 2 моль/м3, СR0 = 0.
Скачать решение задачи 2.2-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-12 Определить равновесную степень превращения реагента А и производительность по продукту R для реакции 2А → R + S, протекающей в газовой фазе, если константа равновесия КС = 0,36, температура проведения реакции Т = 400 К, парциальное давление компонента в исходной смеси РА0 = 0,1 МПа, объемный расход через реактор 2 м3/с, выход по продукту ЕR = 0,9.
Скачать решение задачи 2.2-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-13 Определить константу равновесия, равновесную степень пре-вращения компонента А и состав равновесной реакционной смеси для реакции
A + 2B ↔ 3R,
если G373 = -11,2 кДж/моль, CA0 = 1 кмоль/м3, CB0 = 2 кмоль/м3, Т = 373 К
Скачать решение задачи 2.2-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-14 В газовой фазе протекает реакция А ↔ 2R. Вычислить равновесную степень превращения компонента А при давлении Р = 5 МПа, если Кp = 2,05 МПа-1.
Скачать решение задачи 2.2-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-15 Обратимая реакция A + B ↔ 2R протекает при температуре 298 К и характеризуется тепловым эффектом H298 = -30000 кДж/кмоль и изменением удельной энтропии S298 =-80 кДж/(кмоль-К). Определить, во сколько раз изменится равновесная степень превращения реагентов, если соотношение начальных концентраций реагентов СА0 : Сво изменится от 0,5 до 0,25.
Скачать решение задачи 2.2-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-16 Обратимая реакция A + B - R + S характеризуется следующими термодинамическими параметрами: ΔH3500 = -59500 кДж/кмоль, ΔS3500 = -175,5 кДж/кмоль*K. Определить состав равновесной реакционной смеси, если СА0 = СВ0 = 1,5*102 кмоль/м3, температура проведения процесса Т = 330 К.
Скачать решение задачи 2.2-16 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-17. Обратимая реакция первого порядка A ↔ R характеризуетсяследующими термодинамическими параметрами: ΔH0 = -26000 кДж/кмоль, Kp298 = 17,5. Определить во сколько раз изменится значение равновесной степени превращения xpA, если температуру проведения процесса изменить с 298 до 348 К. Считать, что ΔH0 и ΔS0 не зависят от температуры.
Скачать решение задачи 2.2-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-18. Для обратимой реакции 2A ↔ R + S ΔG2980 = -5620 кДж/кмоль. Определить равновесный состав смеси при температуре 298К, если CA0 = 0,2 кмоль/м3, CR0 = CS0 = 0.
Скачать решение задачи 2.2-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-19 Для обратимой реакции A + B ↔ R + S константы скорости прямой и обратной реакций, л/(моль•с), могут быть рассчитаны по уравнениям: k1 = 6,2•104exp(-27600/(RT), k2 = 7,5•105exp(-32000/(RT). Определить состав равновесной смеси, если СА0 = СВ0 = 2 кмоль/м3, Т = 500 К.
Скачать решение задачи 2.2-19 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-20 Для реакции гидрирования бензола C6H6 + 3H2 ↔ C6H12, проводимой при начальном мольном соотношении реагентов H2 : C6H6 = 10 : 1, равновесная степень превращения бензола равна 0,95. Рассчитать состав равновесной смеси.
Скачать решение задачи 2.2-20 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-21 Рассчитать равновесную степень превращения оксида углерода хр в газофазной реакции CO + H2O ↔ H2 + CO2, протекающей при давлении 0,5 МПа. Исходные реагенты взяты в стехиометрическом соотношении. Константа равновесия реакции k = 8. Найти мольное отношение CO : H2O, необходимое для увеличения хр на 10%.
Скачать решение задачи 2.2-21 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-22 Рассчитать равновесное содержание фосгена, образующегося из оксида углерода и хлора по следующим данным:

Скачать решение задачи 2.2-22 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-23 Рассчитать равновесное содержание триоксида серы при окислении диоксида серы кислородом воздуха по следующим данным:
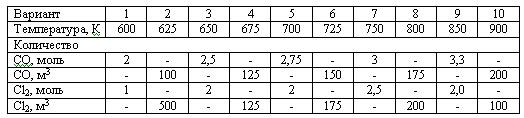
Температурная зависимость константы равновесия Кр, Па-0,5: lg(Kp) = 4905,5/T - 7,4119
Скачать решение задачи 2.2-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-24 Рассчитать равновесное содержание триоксида серы при окислении диоксида серы кислородом воздуха по следующим данным:
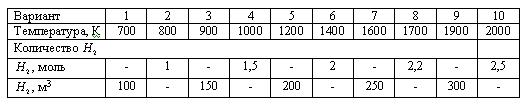
Температурная зависимость константы равновесия Кр, Па-0,5: lg(Kp) = -1190/T + 2,37
Скачать решение задачи 2.2-24 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-25 Газовую смесь, содержащую 20% объемных долей СО и 80% объемных долей N2, пропускают при температуре 1273 К и давлении 0,1 МПа над оксидом железа, который восстанавливается до железа по реакции
FеО + СО = Fе + СО2.
Найти состав равновесной смеси, объемные доли, %, и количество образовавшегося Fе, кг, если константа равновесия равна 0,403. Расчет вести на 1000 м3 исходного газа.
Скачать решение задачи 2.2-25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-26 Для реакции конверсии оксида углерода CO + H2O ↔ H2 + CO2 температурная зависимость константы равновесия имеет вид:
lgKp700 = -2203,24/T + 5,1588*10-5*T+2,5426*10-7*T2 - 7,4617*1011*T3 - 2,3
Найти состав равновесной смеси при температуре 700 К, если в исходной смеси на 1 моль СО приходится 2,4 моль воды.
Скачать решение задачи 2.2-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-28 Зависимость константы равновесия Кр, Па-1, от температуры для реакции дегидрирования вторичного бутилового спирта
C2H5CHOHCH3 = C2H5COCH3 + H2
имеет вид
lgKp = -2790/T + 1,51*lgT+6,869
Найти состав в молярных долях, %, равновесной газофазной реакционной смеси при температуре 600 К и общем давлении 0,2 МПа. если исходная смесь состоит из 1 моль бутилового спирта и 1 моль водорода.
Скачать решение задачи 2.2-28 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-29 Обратимая реакция A + B = 2R с тепловым эффектом ΔН0 = -30,5 кДж/моль и энтропией S0 = -80 кДж/(кмоль•град.) протекает при температуре 298 К. Определить во сколько раз изменится значение равновесной степени превращения вещества А, если соотношение начальных концентраций реагентов А и В уменьшить от 0,5 до 0,25.
Скачать решение задачи 2.2-29 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-30 Дегидрирование этилбензола протекает при температуре 860 К и общем давлении 9,81*104 Па по реакции С6Н5С2Н5 = С6Н5С2Н3 + Н2. Для сдвига равновесия реакции вправо используют введение в исходную смесь инертного компонента (водяного пара). Определить, каким должно быть соотношение пар/этилбензол, чтобы равновесная степень превращения увеличилась на 20 % по сравнению со степенью равновесия, рассчитанной для стехиометрической смеси. Константа равновесия равна 5*104 Па-1.
Скачать решение задачи 2.2-30 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-1 При проведении жидкофазной реакции в реакторе были получены следующие опытные данные:
t, мин 10 30 60 80 100
х 0,31 0,674 0,874 0,95 0,977
Определить порядок реакции.
Скачать решение задачи 2.3-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-2 Дана реакция 2А + 3В = S + 4R + 2F. Определить скорость расходования компонента В и скорость образования продуктов реакции, если скорость исчезновения компонента А составляет 5 моль в единицу времени на единицу объема.
Скачать решение задачи 2.3-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-3 Составить кинетическую модель сложной реакции в которой все реакции протекают по механизму первого порядка.
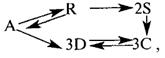
Скачать решение задачи 2.3-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-6. Определить энергию активации и предэкспоненциальный множитель в уравнении Аррениуса для константы скорости реакции, значения которой при температурах 273 и 293 К равны соответственно 2,46 и 47,5 с-1.
Скачать решение задачи 2.3-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-7. Определить энергию активации реакции, если при изменении температуры с 723 до 773 К ее скорость возрастает в 2,73 раза.
Скачать решение задачи 2.3-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-9 Для реакции n-го порядка экспериментально получена зависимость концентрации реагента от времени проведения реакции:
t, мин 0 1 2 3 4 5
С, кмоль/м3 2 0,96 0,63 0,47 0,39 0,31
Определить порядок реакции и вычислить константу скорости.
Скачать решение задачи 2.3-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-11 Для реакции второго порядка 2A → R + S определить степень превращения и скорость реакции через 10, 30 и 50 с. Константа скорости равна 0,02 м3(кмоль-с)-1, начальная концентрация вещества А = 2 кмоль/м3.
Скачать решение задачи 2.3-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-12 Для обратимой реакции 2А = R, протекающей в газовой фазе при постоянном давлении, выразить изменение степени превращения вещества ΔxA/Δt как функцию от степени превращения хА. Прямая реакция второго порядка, обратная - первого.
Скачать решение задачи 2.3-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-13 Выразить скорость обратимой реакции А ↔ 2R как функцию степени превращения. Реакция протекает в газовой фазе при постоянном давлении.
Скачать решение задачи 2.3-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-14 Выразить скорость необратимой реакции как функцию степени превращения исходных веществ для гомогенной реакции взаимодействия гидроксида натрия с этилацетатом.
NaOH + CH3COOC2H5 ↔ CH3COONa + C2H5OH
Скачать решение задачи 2.3-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-15 Для реакции «реагент А > продукты реакции» проводят два эксперимента и поучают следующие данные: Эксперимент 1: СА0 = 2000 моль/м3, при t0,5 = 1/8 ч СА = СА0/2.
Эксперимент 2: СА0 = 1000 моль/м3, при t0,5 = 1/2 ч СА = СА0/2.
Здесь t0,5 – время, за которое концентрация компонента А уменьшаются на половину. На основании этих данных определить порядок реакции.
Скачать решение задачи 2.3-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-17 Дана обратимая реакция Н2 + J2 ↔ 2HJ. Определить время, необходимое для образования 1 моль HJ в реакторе вместимостью 1 л при температуре 550 °С, если исходная смесь состоит из 2 моль водорода и 1 моль йода. При данной температуре константа скорости прямой реакции равна 1,25*10-4 л/(моль-с), а константа скорости обратной реакции - 0,25*10-4 л/(моль*с).
Скачать решение задачи 2.3-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-18 Для обратимой реакции эстерификации этилового спирта с концентрацией 56,5 % массовых долей с помощью муравьиной кислоты с концентрацией 0,07 моль/л k1 = 1,85*10-3 с-1 и k-1 = 1,85*10-3 с-1. Определить равновесную концентрацию муравьиной кислоты и время, необходимое для того, чтобы эстерификаця прошла на 90 %.
Скачать решение задачи 2.3-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-19. При температуре 230С исследуют кинетику реакции первого порядка изомеризации цис-2-бутена в транс-2-бутен хроматографическим анализом реакционной смеси. Получены следующие данные:
Время t,c 0 60 120 155 200
Транс-2-бутен, объемные доли, % 0 5,0 9,2 11 15
По приведенным значениям содержания в смеси транс-изомера можно допустить, что реакция является практически необратимой. какая будет при этом константа скорости реакции?
Через достаточно длительное время содержание в смеси транс-изомера составило 65,5% объемных долей. Рассматривая теперь эту реакцию как обратимую, найти новое значение константы скорости К1.
Скачать решение задачи 2.3-19 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-20 Для обратимой экзотермической реакции A = R + Qр зависимость константы равновесия от температуры задана в виде lnKp= 9000/T-27. Экспериментально установлено, что при температуре 30 °С за время 1140 с степень превращения вещества А хА = 0,79, при 40 °С за 480 с - хА = 0,65. Построить зависимость степени превращения вещества А от температуры и определить оптимальную температуру, при которой достигается максимальная степень превращения, если продолжительность реакции составляет 300 с
Скачать решение задачи 2.3-20 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-21 При постоянной температуре протекает параллельная реакция
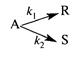
с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, СR0 = СS0 = 0. Определить значение скорости превращения реагента А и продукта 5 в момент времени, когда СR = 0,05 кмоль/м3, СS = 0,5 кмоль/м3. Каким будет это время?
Скачать решение задачи 2.3-21 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-23 Для обратимой реакции A <=> R в начальный момент времени парциальное давление реагента А составляет 1,275*104 Па, а вещества R - 0. Через 10 мин парциальное давление реагента А стало 5,2*103 Па, а вещества R = 7,554*103 Па. Рассчитать парциальное давление реагента А через 20 и 40 мин, если отношение k1/k-1 = 3.
Скачать решение задачи 2.3-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-25. Параллельную реакцию
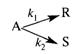
можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечить образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015 ехр[-20000/(R*Т)], k2 = 1014 ехр[-10000/(R*Т)]? Ответ обосновать
Скачать решение задачи 2.3-25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-26 При высокой температуре уксусная кислота разлагается по двум направлениям:
СН3СООН → СН4 + СО2 (1)
СН3СООН → СН2СО + Н2О (2)
Константа скорости реакции и энергия активации реакции (1) при температуре 1189 К равны соответственно 3,74 с-1 и 155000 Дж/моль; для реакции (2) соответственно 4,65 с-1 и 184000 Дж/моль. Рассчитать время, необходимое для того, чтобы уксусная кислота прореагировала на 99 % и максимальный выход кетена.
Скачать решение задачи 2.3-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-27 Хлорирование метилбензола дает смесь пара- и орто-изомеров в соответствии с реакционной схемой
С6Н5СН3 + Cl2 → р-С6Н4С12 + HCl
С6Н5СН3 + Cl2 → о-С6Н4С12 + НС1.
Экспериментально получены следующие результаты:

Учитывая, что обе реакции первого порядка, определить их константы.
Скачать решение задачи 2.3-27 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-29 Протекает последовательная реакция первого порядка А→R→S. Концентрация промежуточного продукта достигает максимального значения через 170 мин. Рассчитайте константы скоростей этих реакций, если хА = 0,4.
Скачать решение задачи 2.3-29 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-30 Для последовательной реакции первого порядка А → R → S рассчитайте CRmax, если: 1) k1 >> k2; 2) k1 = k2; 3) k1 << k2.
Скачать решение задачи 2.3-30 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-31 Протекает последовательная реакция первого порядка А→R→S. Максимальная концентрация продукта R при температуре 250 °С составляет 0,57 СA0. При какой температуре следует проводить реакции, чтобы CRMAX> СA0? Энергия активации целевой реакции равна 48000 Дж/моль, побочной - 39000 Дж/моль. При этом предэкспоненциальные множители в выражениях для констант скоростей обеих реакций примерно равны.
Скачать решение задачи 2.3-31 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-32 Проводится реакция А+В=R с константой скорости k=1*102 л/(моль*ч). Исходные концентрации веществ А и В равны по 0,08 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,04 моль/л.
Скачать решение задачи 2.3-32 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-33 Газофазная реакция А → R + S проводится при постоянном давлении и постоянной температуре. В исходной смеси содержится 100% вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
Скачать решение задачи 2.3-33 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-34 Для параллельной реакции:
A -k1→ 2R
A -k2→ 3S
с константами скоростей k1 = 10-2 с-1 и k2 = 10-3 c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
Скачать решение задачи 2.3-34 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-35 Две параллельные реакции
a1A + b1B = rR + sS (целевая реакция)
a2A + b2B = yY + zZ (побочная реакция)
характеризуются кинетическими уравнениями
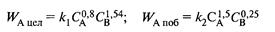
и энергиями активации Е1 = 45 кДж/моль, E2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
Скачать решение задачи 2.3-35 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-37 При проведении последовательной реакции типа А → R → S в изотермических условиях степень превращения реагента составила 0,9. Определить дифференциальную и интегральную селективности по целевому продукту R, если k1 = 0,2 с-1, k2 = 0,1 с-1.
Скачать решение задачи 2.3-37 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-38 Реакция A + B = R + S проводится при температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин. Константа скорости реакции равна 1,28 м3/(кмоль•мин). Оценить количественно влияние начального мольного соотношения реагентов (СА0:СВ0 = 2:1; СА0:СВ0 = 1:1; СА0:СВ0 = 1:1,5; СА0:СВ0 = 1:2) на достигаемую степень превращения вещества А.
Скачать решение задачи 2.3-38 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-1 Горение жидкого топлива протекает во внешнедиф-фузионной области. Топливо впрыскивается в камеру сгорания, образуя капли диаметром 0,1 мм, летящие со скоростью 1,5 м/с. Известно, что капля топлива диаметром 0,3 мм полностью сгорает в потоке такой же скорости за 2 с. Какова длина участка пламени, в котором полностью сгорает топливо?
Скачать решение задачи 2.4-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-2 Гранулированный колчедан подается в печь обжига с движущимся слоем колчедана. Фракционный состав колчедана следующий: 10 % массовых долей частиц с R0 = 3 мм; 20 % массовых долей частиц с R0 = 4 мм; 70 % массовых долей частиц с R0 = 6 мм. Среднее время пребывания частиц в зоне реактора равно 6 мин. Время полного сгорания частиц равно соответственно 3,5 мин, 5 и 8 мин.
Определить среднюю степень превращения колчедана, если процесс лимитируется:
1) химической реакцией;
2) внешней диффузией;
3) внутренней диффузией.
Скачать решение задачи 2.4-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-3 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70 %. Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится в кинетической области.
Скачать решение задачи 2.4-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-5 Гетерогенный процесс описывается реакцией Аг + Вт = Rт + Sг, в котором твердые частицы размером 6 мм за 10 мин реагируют на 95 %. Процесс лимитируется внутренней диффузией.
Определить время той же степени превращения для частиц размером 10 мм.
Скачать решение задачи 2.4-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-6 Твердые частицы размером 6 мм реагируют по реакции Аг + Втв = Rтв + Sг в потоке газа за 400 с на 90 %. Процесс протекает в кинетической области.
Определить среднюю степень превращения твердого вещества за 360 с, если гранулометрический состав смеси следующий: 15 % - частицы размером 2 мм, 60 % - частицы размером 3 мм, 25 % - частицы размером 4 мм.
Скачать решение задачи 2.4-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-7 Гетерогенный процесс описывается реакцией Аг + Вт = Rт +Sг и лимитируется внешнедиффузионной областью. Твердые частицы размером 10 мм полностью реагируют за 15 мин. За время пребывания твердая часть реагирует на 80 %. При переводе процесса в кинетическую область время полного превращения частиц твердого вещества становится равным 12 мин, а при переводе его во внешнедиффузионную область - 10 мин.
Определить степень превращения твердого вещества в кинетической и внешнедиффузионной областях за аналогичное время пребывания.
Скачать решение задачи 2.4-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-8 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70%.Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится во внешнедиффузионной области.
Скачать решение задачи 2.4-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-9 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70%.
Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится в внутридиффузионной области.
Скачать решение задачи 2.4-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-10 В реакторе с кипящим слоем осуществляется восстановление CO2 на углероде. В реактор непрерывно подается свежий углерод, так чтобы объем твердого вещества оставался постоянным и равным 0,1 м3. За 10 мин реакции размер частиц уменьшается в 2 раза.
Определить степень превращения по углероду на данный момент времени, время полного превращения углерода и среднюю массовую скорость подачи углерода в реактор, если насыпная плотность углерода 480 кг/м3.
Скачать решение задачи 2.4-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-11 Гетерогенный процесс описывается реакцией A(Г) + B(ТВ) = R(Г) + S(ТВ), в котором твердые частицы размером 12 мм за 20 мин реагируют на 75% при лимитирующей стадии внутренней диффузии. На сколько сократится время пребывания в зоне реакции той же степени превращения, если размер частиц уменьшить в 2 раза?
Скачать решение задачи 2.4-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-12 Твердые частицы размером 6 мм реагируют по реакции Аг + Вт = Rт +Sг в потоке газа за 400 с на 80 %. Процесс протекает во внешнедиффузионной области.
Какое должно быть время пребывания вещества для достижения 90 %-ной степени превращения по твердому веществу, если гранулометрический состав твердой смеси следующий: 40 % - частицы размером 2 мм, 50 % - частицы размером 4 мм и 10 % - частицы размером 6 мм?
Скачать решение задачи 2.4-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-13 Гетерогенный процесс описывается реакцией AГ + BТВ = RГ в котором твердые частицы размером 6 мм имеют степень превращения 95%. Константа скорости реакции - 0,8 см/с, а коэффициент массоотдачи - 0,3 см/с. Концентрация реагента А в газовом потоке - 0,02 моль/л.
Рассчитать скорость превращения газового реагента, отнесенную к единице объема твердой фазы при заданной хтв.
Скачать решение задачи 2.4-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-15. В реакторе осуществляется гетерогенный процесс, описываемый реакцией Aж + Bтв → RГ, в котором твердые частицы размером 10 мм имеют степень превращения 90%. Константа скорости реакции - 0,6 см/с, коэффициент массоотдачи - 0,4 см/с. В качестве жидкой фазы используется серная кислота 80%-ной концентрации, а в качестве твердой фазы - железо, плотность которого равна 7 г/см3. Концентрация СA0 = 0,015 моль/л, СB0 = 0,125 моль/л.
Рассчитать наблюдаемую скорость процесса, отнесенную к единице объема твердой фазы, если время пребывания частиц в зоне реакции равно 20 мин.
Скачать решение задачи 2.4-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-1 Рассчитать и построить зависимость степени использования внутренней поверхности катализатора от модуля Зельковича-Тилле.
Скачать решение задачи 2.5-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-2 Степень использования внутренней поверхности катализатора равна 0,7. Размер пластинчатого зерна катализатора составляет 6 мм.
Определить эффективный коэффициент диффузии и область протекания процесса при проведении каталитической реакции типа A -> R с константой скорости 0,12 с-1.
Скачать решение задачи 2.5-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-3 Каталитическая реакция типа A = R проводится на пластинчатых зернах катализатора размером 3 мм. Константа скорости равна 1,85 с-1. Эффективный коэффициент диффузии составляет 0,06 см2/с.Определить степень использования внутренней поверхности катализатора и область протекания процесса.
Скачать решение задачи 2.5-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-4 Как изменится скорость каталитического процесса и степень использования внутренней поверхности пористого катализатора в виде пластин размером 2R0 = 5 мм, если понизить температуру с 560 до 500 К? Реакция первого порядка с константой скорости, с-1, определяемой уравнением k = 3,5•106exp(-7600/T). Эффективный коэффициент диффузии остается неизменным и равным 0,7 см2/с.
Скачать решение задачи 2.5-4 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-5 Проводится реакция первого порядка на пористом катализаторе пластинчатого типа с толщиной пластины 4 мм. Константа скорости равна 0,3 с-1. Эффективный коэффициент диффузии составляет 0,5 см2/с. Как изменится наблюдаемая скорость процесса и степень использования внутренней поверхности катализатора, если взять катализатор с толщиной пластинки 6 мм?
Скачать решение задачи 2.5-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-6 Как изменится скорость каталитического процесса и степень использования внутренней поверхности пористого катализатора в виде пластин размером 2R0 = 5 мм, если понизить температуру с 560 до 500 К? Реакция первого порядка с константой скорости, с-1, определяемой уравнением k = 3,5•106exp(-7600/T). Эффективный коэффициент диффузии остается неизменным и равным 0,7 см2/с.
Скачать решение задачи 2.5-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-7 Как изменится наблюдаемая скорость каталитического процесса и степень использования внутренней поверхности сферического катализатора радиусом 8 мм, если температуру изменить с 559 К до 653 К? Реакция первого порядка. Константа скорости, с-1, определяется уравнением k = 4,2*106exp(-8200/T). Эффективный коэффициент диффузии равен 0,6 см2/с и не зависит от температуры.
Скачать решение задачи 2.5-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-8 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка типа A → R при изменении температуры с 700 до 600 К и его формы с пластинчатой (2R0 = 4 мм) на таблетированную (2R0 = 4 мм, H= 1/3*D). Эффективный коэффициент диффузии равен 0,02 см2/с, константа скорости реакции при температуре 810 К составляет 3,2 с-1, энергия активации данной реакции -36700 Дж/моль.
Скачать решение задачи 2.5-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-9 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка А → R, если сферический катализатор диаметром 6 мм заменить пластинчатым с размером пластины 2R0 = 4 мм. Эффективный коэффициент диффузии равен 0,3 см2/с, константа скорости реакции при температуре 700 К составляет 0,82 с-1.
Скачать решение задачи 2.5-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-10 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка типа А -> R на сферическом катализаторе диаметром 6 мм при изменении температуры с 603 до 703 К. Эффективный коэффициент диффузии равен 0,09 см2/с, константа скорости реакции при температуре 653 К составляет 1,52 с-1, энергия активации данной реакции - 56,56 кДж/моль.
Скачать решение задачи 2.5-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-12 На непористом катализаторе протекает реакция первого порядка. Константа скорости, отнесенная к единице объема катализатора, при температуре 500 К равна 1,5 с-1. Энергия активации реакции составляет 84 кДж/моль. Коэффициент массоотдачи из потока газовой фазы к поверхности катализатора равен 2,5 м/с и не зависит от температуры.
Построить зависимость lnkН = f(1/T) в интервале температур 450 - 800 К, определить область протекания процесса и как будет изменятся наблюдаемая энергия активации данной реакции.
Скачать решение задачи 2.5-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)


