Расчеты реакторов различных типов
Задача ОХТ 77. В однослойном каталитическом реакторе, работаю-щем в режиме идеального вытеснения, осуществляется обратимая экзотермическая реакция окисления SO2 в фильтрующем слое ванадиевого катализатора: SО2 + 0,5О2 = SО3. Температура в слое катализатора равна 570 °С (считаем ее постоянной во всем слое). Исходный газ содержит [% (об.)]: SО2 - 11; О2 - 10; N2 - 79. Расход газа 15500 м3/ч. Скорость газа в аппарате w = 1,4 м/с. Константа скорости реакции окисления SО2 в SОз при 585 °С равна 13,7. Константа равновесия определяется по формуле:
4905/T - 4,6455
Энергия активации E = 87800 кДж/моль. Коэффициент запаса фэ = 1,3.
Определить: 1) реакционный объем реактора, т. е. объем катализатора, который следует загрузить в реактор, чтобы обеспечить степень превращения SО2 в SО3, равную 0,5; 2) диаметр реактора и высоту слоя катализатора.
Скачать решение задачи ОХТ 77 (цена 100р)
Задача ОХТ 78. Газ, выходящий из реактора окисления аммиака, быстро охлаждают для конденсации из него основной части водяных паров. Газ содержит [% (мол.)]: NO - 9; NO2-1; O2 - 8. До поступления на абсорбционные колонны, где получается азотная кислота, газ окисляется до отношения NО2: NO, равного 5:1. Расход газа на входе в реактор 10000 м3/ч, давление газа 0,1 МПа. Рассчитать объем реактора вытеснения, необходимый для достижения указанной цели, в предположении, что охлаждение является достаточно эффективным для поддержания постоянной температуры реакционной смеси на уровне 20 °С.
Скачать решение задачи ОХТ 78 (цена 80р)
Задача ОХТ 79. Уксусный ангидрид подвергают гидролизу в реакторе с мешалкой, работающем в режиме полного смешения. Концентрация уксусного ангидрида в исходной смеси СНач = 0,3 моль/л. Степень превращения (по отношению к исходной смеси) xКон = 0,7. Объемный расход жидкости постоянен VСм = 20 л/мин. Процесс идет при большом избытке воды. Константа скорости гидролиза k = 0,38 мин-1. Определить: 1) объем единичного реактора смешения, обеспечивающий заданную степень превращения; 2) реакционный объем, требующийся для проведения того же процесса при тех же условиях в реакторе идеального вытеснения; 3) число ступеней, т. е. единичных реакторов смешения, требующихся для того, чтобы общий реакционный объем приближался к объему реакто¬ра вытеснения.
Скачать решение задачи ОХТ 79 (цена 60р)
Задача ОХТ 80. Реакция 2А = В + С протекает непрерывно в батарее из трех реакторов с перемешиванием при расходе реагентов Vcм =10 м3/ч. Концентрация вещества А в исходном растворе САнач = 1,5 кмоль/м3, концентрации С и В равны 0. Константа скорости прямой реакции k1 = 10 м3/(кмоль-ч), константа равновесия K =16,0. Необходимая степень превращения должна составлять 80% от равновесной. Определить объем одного реактора, полагая, что на всех ступенях он одинаков.
Для производства 50 т/сут этилацетата по реакции
С2Н5ОН (A) + СН3СООН (B) = СН3СООС2Н5 (C) + Н2О (D)
запроектирован реактор с мешалкой периодического действия. Реакция протекает в жидкой фазе при 100°С по уравнению
uA = k (CA*CB-(CD*CR/K))
где k = 7,93*10^-6 м3/ (кмоль - с) ; K = 2,93. Загруженный в реактор водный раствор плотностью 1020 кг/м3 содержит 23% (масс.) кислоты и 46% (масс.) этанола и не содержит этилацетата. Его плотность остается неизменной на протяжении всего процесса. Заданная степень превращения кислоты 35%. Время загрузки и разгрузки реактора 1 ч.
Затем производство перевели на непрерывное, сохраняя тот же состав исходной смеси и ту же степень превращения. Рассчитать: 1) объем реактора при периодическом производстве; 2) какова производительность реактора, если он будет работать непрерывно; 3) какой объем реакционной зоны необходим, если реакция проводится непрерывно в трехступенчатом реакторе смешения. Для упрощения расчета принимается, что процесс происходит в кинетической области при изотермическом режиме во всех типах реакторов.
Скачать решение задачи ОХТ 80 (цена 80р)
Расчеты каталитических процессов и реакторов
Задача ОХТ 81. Определить производительность 1 м3 катализатора синтеза аммиака при следующих условиях: концентрация [%(об.)] аммиака в конечном газе (на выходе из реактора) Скон = 26,5, в начальном газе (на входе в реактор) Снач = 2,7. Объемная скорость газа 1/об = 45 000 м3/ (ч - м3).
Скачать решение задачи ОХТ 81 (цена 80р)
Задача ОХТ 82. Определить объем катализатора икат в колонне синтеза аммиака и время контакта т газа с катализатором по следующим исходным данным: производительность реактора 96 т NН3 в сутки; давление Р = 80 МПа; температура t = 500°С; объемная скорость Vоб = 60000 м3/(ч-м3); степень превращения x=20%. Свободный объем катализатора Vси = 30% от общего его объема. На 1 т NН3 расходуется 3000 м3 азотоводородной смеси. Для упрощения расчета наличие инертных примесей в газе не учитывать.
Скачать решение задачи ОХТ 82 (цена 80р)
Задача ОХТ 83. В лабораторном реакторе ведется изучение процесса окисления метанола в формальдегид на твердом оксидном катализаторе избирательного действия. Установка имеет циркуляционную схему с выводом продукта из цикла. Скорость циркуляции смесл через установку (с помощью насоса) во много раз превышает скорость подвода исходного газа и отвода продукта, и степень превращения за один проход газа через реактор составляет очень малую долю общей степени превращения. Окисление метанола идет по необратимым реакциям:
СН3ОН + 0,5О2 = СН2О + Н20 (1)
СН2О + 0,5О2 = СО + Н2О (2)
Определить константы скоростей реакций (1) и (2) в присутствии избирательного катализатора по следующим исходным данным: расход газа Vг - 10 л/ч; объем катализатора Vкат=5 см3; начальная концентрация СН3ОН в метаноло-воздушной смеси Бензол = 6,5% (об.); общая степень превращения СН3ОН х1 = 0,98; степень превращения СН3ОН в продукт (формальдегид) х2 = 0,9.
Скачать решение задачи ОХТ 83 (цена 80р)
Задача ОХТ 84. По данным лабораторного исследования, рассмотренного в Задача ОХТе 3, определить размеры однополочного реактора КС производительностью П= 15000 т в год формалина с концентрацией 37% СН2О: диаметр реактора D; объем катализатора; высоту слоя катализатора (в покое). Линейная скорость газа wг = 0,6 м/с.
Скачать решение задачи ОХТ 84 (цена 80р)
Задача ОХТ 85. Для тех же условий, а также заданных и найденных ранее параметров (см. примеры 3 и 4) ориентировочно определить объем катализатора в реакторе КС для окисления метанола в формальдегид при секционировании реактора на три слоя. Заданная степень превращения x1 = 0,98.
Скачать решение задачи ОХТ 85 (цена 80р)
Задача ОХТ 86. Экзотермическая реакция первого порядка протекает в фильтрующем слое катализатора. Начальная температура в слое tнач = 3000С. В результате адиабатического режима в реакторе температура в слое повышается до tкон. Ту же реакцию проводят затем в реакторе со взвешенным слоем катализатора при режиме, близком к полному смешению.
Определить соотношение констант скоростей данной реакции в изотермических условиях взвешенного слоя и в адиабатических условиях неподвижного слоя по следующим данным: заданная степень превращения х = 0,35; энергия активации каталитической реакции E = 20 000 кДж/кмоль; тепловой эффект реакции q = 22800 кДж/кмоль; теплоемкость реакционной смеси с = 19 кДж/(кмоль-°С); концентрация основного исходного веще¬ства на входе в реактор Сисх = 5,2-10-3 кмоль/м3.
Скачать решение задачи ОХТ 86 (цена 80р)
Задача ОХТ 87. Реакцию окисления NО проводят на катализаторе - активном и промотированном угле. Изучение кинетики этой каталитической реакции показало, что ее скорость [кмоль/(кг-ч)] можно описать эмпирическим уравнением
u = pNO^2 * pO2 / (a + b*pNO^2 + c*pNO2^2)
где а = 16,19; 6 = 4,842- 105; с= 135.
Насыпная плотность катализатора ркат = 480 кг/м3; P = 0,3 МПа. В исходной газовой смеси содержится 1,5% (мол.) N0, остальное - воздух.
Определить объем реактора производительностью 50 т NО2 в сутки, обеспечивающий степень превращения x = 90%.
Скачать решение задачи ОХТ 87 (цена 80р)
Задача ОХТ 88 Каталитическая газовая реакция А -> 4R протекает под давлением 0,31 MПа при 117°С в лабораторном реакторе идеального вытеснения. Через него пропускают исходную газовую смесь, которая включает продукт, образующийся из чистого вещества А. Расход реагента А составляет 20 л/ч. Получены следующие результаты:

а. Определить, каково кинетическое уравнение этой реакции.
б. Применяя найденное кинетическое уравнение, найти объем катализатора (л), который обеспечивает степень превращения А в R, равную 0,35, при заданных T и P и скорости подачи исходного реагента 2000 моль/ч.
Скачать решение задачи ОХТ 88 (цена 80р)
Задача ОХТ 89. В опытном трубчатом реакторе, в котором находится 2 г (1 см3) катализатора, производится исследование кинетики газовой каталитической реакции А -> R. Исходную газовую смесь, содержащую различные количества продуктов реакции, пропускают через установку, замеряя концентрацию вещества А до контакта с катализатором и после него. Результаты анализов следующие:
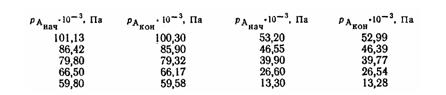
Скорость подачи газовой смеси Vг = 0,01 л/с при давлении P = 1,013-105 Па и температуре t = 450°С. Определить: а) кинетическое уравнение этого процесса в единицах концентрации газа и при отнесении скорости к насыпному объему катализатора: б) объем реактора идеального вытеснения, который обеспечил бы степень превращения х вещества А, равную 50%, при скорости подачи газа Vг = 20 кмоль/ч.
Скачать решение задачи ОХТ 89 (цена 80р)
Задача ОХТ 90. Процесс каталитического окисления аммиака происходит в реакторе поверхностного контакта при давлении Р = 0,1 МПа. Определить необходимую высоту слоя катализатора (пакеты сеток из платины) в реакторе для следую¬щих исходных данных, состав исходного газа [%(об.)]: NН3- 10 воздух - 90. Степень превращения NН3 в NO - 0,95. Температура исходного газа 20°С. Температура в зоне реакции ниже обычно применяемой и составляет 700°С. Производительность реактора (считая на 1 м2 поверхности катализатора) 600 кг NH3 в сутки. Массовая скорость газа Сг = 573,6 кг/(м2-ч). Диаметр платиновой проволоки (из которой выполнены сетки) 0,06 мм.
Скачать решение задачи ОХТ 90 (цена 80р)
Задача ОХТ 91. Определить гидравлическое сопротивление филь» трующего слоя катализатора высотой H = 1,7 м в реакторе диаметром D = 2,5 м. Расход газа Vг = 8500 м3/ч, плотность газа рг = 0,45 кг/м3, вязкость газа мг= 0,294- 10-4 Па-с. Удельная внешняя поверхность зерен катализатора SУД = 415 мг/м3, порозность е = 0,43. По данным исследований принято, что число т частиц катализатора в 1 м3 слоя составляет 10^6. Определить также коэффициент формы Ф и эквивалентный диаметр dэ каналов в слое.
Скачать решение задачи ОХТ 91 (цена 80р)
Задача ОХТ 92. В лабораторном реакторе исследуется каталитическая реакция во взвешенном слое катализатора Фишера - Тропша (никелевый прессованный). Исходные данные: диаметр реактора D = 0,61 м; объем слоя в покое V = 0,093 м3; массовая скорость газа Gг = 7,0 кг/(м2-ч); плотность частиц катализатора р = 5000 кг/м3; коэффициент сферичности частиц Ф = 0,58; вяз¬кость газа мг = 0,256*10^-3 Па-с; плотность газа на входе в тор рг.вх= 14,45 кг/м3, на выходе ргвых= 16,52 кг/м3, Определить: а) наибольший размер частиц dmax, при котором начинается их взвешивание; б) степень расширения слоя, полагая dcp= 0,6*dmax
Скачать решение задачи ОХТ 92 (цена 80р)
Задача ОХТ 93. В реакторе со взвешенным слоем серебряного катализатора (нанесенного на алюмосиликатный носитель) ведется процесс неполного окисления метана природного газа с целью получения формальдегида. Начальный состав газовой смеси [природный газ, содержащий 97,1% (об.) СН4, с добавлением воздуха], % (об.): СН4 -26,5; О2-14,8; N2 -58,7. Конечный состав газовой смеси (после извлечения растворимых продуктов реакций), % (об.): СН4 -25,8; О2-11,8; СО2 -0,2; СО -0,4; СnНm- 0,2; Н2-1,0; 1N2 - 60,5. Объемная скорость газа Vоб = 3000 ч-1; температура в зоне реакции 750°С. На 1 м3 природного газа получается 30 г СН2О и 3,4 г СН3ОН. Диаметр реактора 1 м. Частицы катализатора сферические, средний диаметр dср = 1,5 мм. Плотность катализатора рт=1200 кг/м3. Плотность газа рг = 1,215 кг/м3 (в рабочих условиях). Вязкость газа мГ = 1,835*10^-5 Па-с (в рабочих условиях).
Определить: а) степень превращения х метана в целевые продукты - формальдегид и метанол; б) критическую wвзв и рабочую wр скорости взвешивания; в) производительность реактора П, объем катализатора vкат, высоту его слоя Н и гидравлическое сопротивление P.
Скачать решение задачи ОХТ 93 (цена 80р)
Задача ОХТ 94. В реактор установки каталитического крекинга с движущимся слоем шарикового катализатора поступают параллельно потоки паров сырья и катализатора.
Известны следующие характеристики процесса: поток сырья GС=13,5 кг/с (48,6 т/ч); поток катализатора Gкат = 27 кг/с (97,2 т/ч); температуры поступающего сырья ТСнач = 748 К и поступающего катализатора Ткатнач =783К; теплоемкости сырья с = 3000 Вт-с/(кг-К) и катализатора скат=1000 Вт-с/(кг-К); диаметр зерен катализатора d = 0,003 м; порозность в реакционной зоне е = 0,5; коэффициент теплоотдачи от зерен катализатора к парам сырья a = 465 Вт/(м2-К). Определить объем зоны интенсивного теплообмена vкатт, на выходе из которой температуры потоков отличаются на 1 °С от температуры теплового равновесия.
Скачать решение задачи ОХТ 94 (цена 80р)
Задача ОХТ 95. Каталитическое окисление SO2 в SО3 должно производиться в четырехполочном реакторе со взвешенными слоями ванадиевого катализатора. Состав исходного газа [% (об.)]: SО2-11; О2-10; N2 -79. Общая степень превращения х = 0,97. Принимается следующее распределение степени превращения по полкам реактора (слоям катализатора):
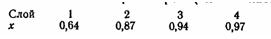
1. Построить оптимальную и равновесную кривые х - Т, а также изотермы, отвечающие температурному режиму в каждом слое.
2. Определить константу скорости реакции и ориентировочно объем катализатора в первом и втором слоях по следующим дополнительным данным: скорость газовой смеси (расход газа) в условиях первого слоя VГ1 = 31000 м3/ч; коэффициент запаса ф3, = 1,1- для первого слоя, Ф32=1,2 - для второго слоя.
3. Определить поверхность холодильников, погруженных во второй слой катализатора по следующим дополнительным дан¬ным.
По данным материального баланса на входе во второй слой расход компонентов газа V и их удельная теплоемкость с составляют:

Физические и гидродинамические параметры, характеризующие условия второго слоя: Аr = 2,26-104 (значение критерия Архимеда определено аналогично Задача ОХТам 14 и 15); диаметр частиц dч=0,0015 м; теплопроводность газа лг = 0,06 Вт/(м-°С); плотность газа рг = 3,74 кг/м3; кинематический коэффициент вязкости мг = 6,6*10^-5 м2/с. Холодильник выполнен из стали, диаметр труб dтр = 0,035 м, толщина стенки бСТ = 2,5 мм, теплопроводность лСт = 46,4 Вт/(м-°С). Температура воды: tнач = 15°С; tкон = 80°С. При средней температуре воды (tНач + tКОН)/2 = 47,5°С: мв = 0,57*10^-3 Па-с, лв = 6,45 Вт/(м-°С). Скорость течения воды по трубам wХол = 0,4 м/с.
Скачать решение задачи ОХТ 95 (цена 80р)
Задача ОХТ 96. Выполнить ориентировочный расчет колонны синтеза аммиака по следующим исходным данным. Синтез аммиака производится в полочном реакторе (колонне) со взвешенными слоями железного мелкопористого катализатора, промотированного добавками Аl2О3, К2О, СаО, SiO2. Выбранный катализатор устойчиво эксплуатируется в следующих пределах рабочих температур: tМакс = 540°С, tмин = 475°С. Плотность частиц катализатора рт = 3500 кг/м3. Для проведения синтеза при температурном режиме, близком к оптимальному, число полок (слоев катализатора) принято i = 5.
Фракционный состав катализатора с учетом исследования гидродинамики процесса выбран следующий (d - диаметр частиц) :
Первый и второй слои d1= d2=1,5 мм
Третий и четвертый слои d3 = d4 = 2,0 мм
Пятый слой d6 = 2,5 мм
Колонна синтеза работает под давлением 30 МПа с вторичной конденсацией аммиака. Соотношение Н2: N2 в исходной азотоводородной смеси близко к стехиометрическому. Содержание инертных примесей (СН4 + Аг) в газе Син = 0,96% (об.). Динамический коэффициент вязкости газовой смеси при 30 МПа мг = 3,0*10^-5 Па-с. Данные материального баланса колонны синтеза для этих исходных условий приведены без расчета в следующей таблице:
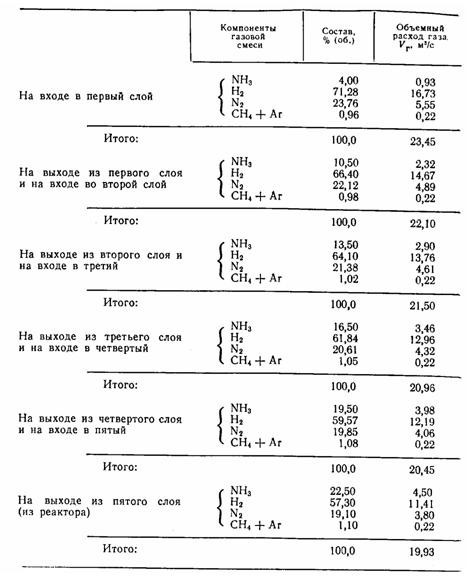
а. Определить содержание аммиака в равновесной газовой смеси в выбранном интервале температур, построить равновесную кривую и кривую оптимальных температур.
б. Определить критические скорости взвешивания, рабочие скорости газа и площадь сечения катализаторной коробки реактора.
в. Рассчитать константы скорости реакции и определить высоту слоев и общий объем катализатора, загружаемого в реактор; определить гидравлическое сопротивление слоев катализатора.


