Раздел 5 и 6 Материальные и тепловые балансы ХТС
Задача 5-2. В абсорбционную установку подается 20000 м3/ч газа с содержанием 7,8% объемных долей SO2. В результате абсорбции получают олеум с содержанием 10% свободного SO3 и 93% - массовых долей серной кислоты. Степень поглощения триоксида серы в первом абсорбере равна 40%, а общая степень абсорбции - 0,995%. Рассчитать материальный баланс установки.
Скачать решение задачи 5.2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-5 В установку конверсии метана аодяным паром (см. рис 5.2) подается 20000м метана. Степень конверсии метана равна 0,98. Оксид углерода, образующийся в результате конверсии метана, подвергается конверсии водяным паром в следующем реакторе и степень его конверсии составляет 0,96. Рассчитать материальный баланс установки конверсии метана с соотношением метана к водороду как 1:3,1.
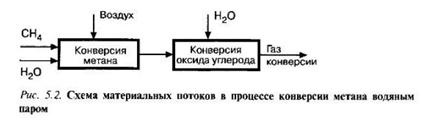
Скачать решение задачи 5-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-6 Составить материальный баланс ХТС (рис.) производства 1500 кг/ч 36%-ной ортофосфорной разложением апатита, содержащего % (масс.): СаО - 52, Р2О5 - 34, F - 4, остальное балласт, серной кислотой концентрацией 63 %. Степень разложения фосфорита составляет 96 %, степень отмывки кислоты на фильтре 0,99. Соотношение твердой и жидкой фаз на выходе из реактора должно быть 1:3. Влажность твердой фазы на выходе равна 35 % массовых долей.
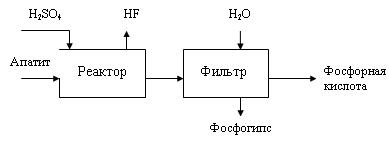
Скачать решение задачи 5-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-7 Составить материальный баланс реактора окисления аммиака, в который поступает аммиачно-воздушная смесь с расходом 10000 м3/ч, содержащая 9 об. долей аммиака. Степень превращения аммиака 0,98, а селективность по оксиду азота 0,95. Побочным продуктом считать только азот.
Скачать решение задачи 5-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-8 Составить уравнения материального баланса для расчета материальных потоков ХТС синтеза аммиака (рис. 5.4), если объем входящего газа V0. концентрация метана в аммиачно-воздушной смеси (АВС) ССН4, степень превращения АВС в реакторе Х, рециркуляционный газ имеет состав: СН4, NH3 и АВС.
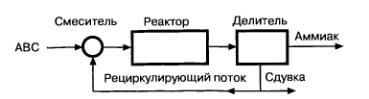
Схема материальных потоков в установке синтеза аммиака
Скачать решение задачи 5-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-9 Рассчитать материальный баланс ХТС синтеза аммиака производительностью 10000 кг/ч аммиака из азото-водородной смеси (АВС), содержащей 0,5 объёмных долей СН4, %. Степень превращения АВС в реакторе равна 0,18. Состав рециркуляционного газа: СН4 – 6,0 %, NН3 – 3,0 %, остальное АВС.
N2 + 3H2 = 2NH3
Скачать решение задачи 5-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-10. Рассчитать состав и количество нитрозных газов, получаемых при окислении 850 м3/ч аммиачно-воздушной смеси, содержащей 9% аммиака. степень окисления аммиака 0,97, а выход оксида азота составляет 0,95.
Скачать решение задачи 5-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-11 В абсорбционную установку подается 15000 м3/ч газа с содержанием 8,3% долей SО2. В результате абсорбции получают олеум с содержанием 20% свободного SO2 и 98%-ную серную кислоту. Степень абсорбции в олеумном абсорбере равна 0,2, а общая степень абсорбции - 0,99%. Рассчитать материальный баланс установки.
Скачать решение задачи 5-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-13 Составить материальный баланс печи для сжигания серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,5. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи 5-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-14 Составить материальный баланс производства оксида этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси -3% объемных долей этилена в воздухе. Степень окисления этилена 0,5. Расчет вести на 1 т оксида этилена. Процесс описывается химическим уравнением:
2CH2=CH2 + O2 = 2(CH2)2O
Скачать решение задачи 5-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-16 Составить материальный баланс хлоратора в производстве 1 т хлорбензола. Содержание продуктов в массовых долях, %: бензол – 65,0; хлорбензол – 32,0; дихлорбензол – 2,5; трихлорбензола – 0,5. Технический бензол содержит 97,5 % массовых долей С6Н6, технический хлор – 98 % массовых долей Cl2.
Скачать решение задачи 5-16 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-17 Составить материальный баланс нитратора производительностью 3 т/ч нитробензола. Выход нитробензола 98 % от теоретического. Состав нитрующей смеси [% (масс.)]: HNO3 – 20; H2SO4 – 60; H2O – 20. Расход нитрующей смеси составляет 4 кг на 1 кг бензола:
С6H6 + HNO3 = C6H5NO2 + H2O.
Скачать решение задачи 5-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-18 Составить материальный баланс установки для получения аммиачной селитры производительностью 20 т NН4NО3 в час влажностью 5% массовых долей. В производстве применяется 47%-ная азотная кислота и 100%-ный газообразный аммиак. Потери азотной кислоты и аммиака в производстве составляют 1% производительности. Из нейтрализатора аммиачная селитра выходит в виде 60%-ного раствора NН4NО3 в воде. Определить количество влаги, испарившейся в результате экзотермической реакции нейтрализации
НNО3 + NН3 = NН4NО3.
Скачать решение задачи 5-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-19 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. плотность раствора при условиях электролиза 1,17кг/л. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 1000м хлора
Скачать решение задачи 5-19 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-22. Составить материальный баланс производства 1 т сульфата натрия, если в производстве используется поваренная соль, содержащая 97% NaCl, и купоросное масло, содержащее 93% массовых долей H2SO4. Степень разложения NaCl составляет 93%.
Скачать решение задачи 5.22 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-23. Составить материальный баланс производства 1 т технического сульфида натрия (содержание 96%мас.) из сульфата натрия (содержание 95,5% мас.) и электролитического водорода (содержание водорода 97%мас.). На побочные реакции расходуется 2% и водорода от теоретически необходимого количества для получения 1 т технического продукта.
Процесс можно описать уравнением реакции:
Na2SO4 + 4H2 →Na2S+4H2O
Скачать решение задачи 5-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-24 Рассчитать материальный баланс производства 10000т/ч 90,4%-ной серной кислоты из серного колчедана, содержащего 42% серы, при условии, что степень выгорания веры в колчедане составляет 97%, степень каталитического окисления диоксида серы - 99,3%, а степень абсорбции триоксида серы -99,5%. Обжиговый газ содержит 8% диоксида серы. Воздух влажностью 55% перед подачей в печь для обжига колчедана подвергается осушке получаемой серной кислотой.
Скачать решение задачи 5-24 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-25. Составить материальный баланс производства 61% - ной азотной кислоты при условии, что выход оксида азота при окислении аммиака составляет 97%. Побочные продукты окисления – только азот. Степень абсорбции диоксида азота равна 99%. аммиачно-воздушная смесь перед реактором окисления содержит 9% аммиака. Воздух, подаваемый в производство, имеет относительную влажность 47%.
Скачать решение задачи 5.25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-26 По условиям задачи 5-25 составить тепловой баланс реактора окисления аммиака, считая, что температура воздуха равна 21 °С. Окисление аммиака ведется при температуре 850 °С. Потери теплоты в окружающую среду составляют 5% общего количество теплоты.
Скачать решение задачи 5-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-27 Составить материальный баланс реактора окисления аммиака, в который поступает аммиачно-воздушная смесь с расходом 60000 м3/ч, содержащей 10% объемных долей аммиака. Селективность по оксиду азота составляет 0,95 при полном превращении аммиака. Принять, что в качестве единственного побочного продукта образуется азот.
Окисление аммиака протекает по механизму:
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
Скачать решение задачи 5-27 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-28 Составить тепловой баланс реактора окисления аммиака, в котором протекают реакции:
4NH3 + 5O2 = 4NO + 6H2O + 980 кДж (1)
4NH3 + 3O2 = N2 + 6H2O + 1270 кДж (2)
Расход аммиачно-воздушной смеси 60000 м3/ч, содержание аммиака 10 % долей. Селективность по оксиду азота 0,95 при полном превращении аммиака.
Скачать решение задачи 5-28 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-31 Составить материальный баланс процесса газификации 1 т кокса, идущей по реакциям:
С + H2O = CO + H2 + 131кДж
CO + H2O = CO2 + H2 + 42кДж
В коксе содержится 3% массовых долей зольных примесей, массовое соотношение пар/кокс составляет 1,5, степень превращения углерода в коксе -0,98, выход монооксида углерода-0,90.
Скачать решение задачи 5-31 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-33 Составить материальный баланс, рассчитать выход и количество выделенной теплоты при обжиге 1000кг при стехиометрической подаче воздуха:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3416кДж.
Колчедан содержит пирит FeS2 и несгораемые примеси. Содержание серы в колчедане 41%, а в огарке - 0,5%.
Скачать решение задачи 5-33 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-35 Составить материальный баланс производства 1500 кг/ч аммиачной селитры влажностью 3% массовых долей, получаемой нейтрализацией аммиачной воды, содержащей 25% массовых долей аммиака, азотной кислотой, содержащей 58% массовых долей HNO3 при температуре 105 С. Водный раствор аммиачной селитры подают на вакуумный парной аппарат для удаления воды, а плав селитры после выпарки – на грануляцию. Степень превращения по азотной кислоте и аммиаку равна 100%. Потери аммиака в производстве селитры составляют 3% массовых долей.
Скачать решение задачи 5-35 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 5-37 Составить материальный и тепловой балансы реактора полимеризации стирола. Стирол в количестве 2000 кг/ч подастся в реактор при температуре 50 °С. Реакция полимеризации осуществляется в изотермическом режиме. Температура реакционной массы на выходе равна 145°С. Степень превращения стирола составляет 0,9. Температура охлаждающей воды на входе равна 20°С, а на выходе - 60 °С. Принять теплоемкости компонентов реакционной смеси следующими:
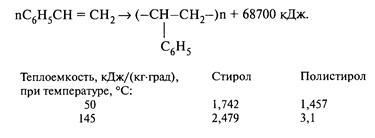
Скачать решение задачи 5-37 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 6-2 Рассчитать материальный баланс производства экстракционной фосфорной кислоты из апатитового концентрата, содержащего 39,4 % Р2О5, 52 % СаО и 3 % фтора. Норма серной кислоты 100 % от стехиометрической на СаО. Коэффициент извлечения Р2О5 в продукционной кислоте 32 %. В газовую фазу выделяется 20 % фтора от содержащегося в сырье. Влажность гипса на карусельном фильтре: в первой зоне – 47 %, во второй – 44,2 %, в третьей – 42 %, в четвертой – 40 %. В процессе фильтрации 1 т апатитового концентрата испаряется 29,5 кг воды.
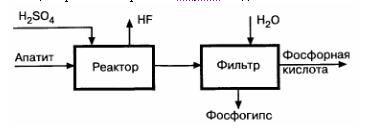
Расчет провести на 1 т апатитового концентрата.
Скачать решение задачи 6-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)


