Кинетическое моделирование гетерогенных реакций
Лабораторная работа № 1
Кинетическое моделирование гетерогенных реакций
Часть 1. Система с одной реакцией без изменения количества вещества.
Реакция водяного газа имеет место во многих процессах переработки природного газа, газификации угля и т.п.
CO2 + H2 = CO + H2O
Эта реакция достаточно изучена, известна зависимость константы ее равновесия от температуры.
В [1] исследовался синтез метанола на катализаторе со следующими характеристиками: состав Cu/ZnO/Al2O3, мольное отношение Cu/Zn/Al = 60/30/10, форма — цилиндрические гра-нулы 5 мм диаметром и 5 мм высотой. Было предложено описывать кинетику реакции водяного газа следующим уравнением
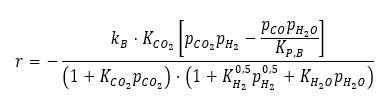
Константа скорости реакции (стадии, определяющей скорость) kB=1,16*1011 exp(-126573/RT)
Константа равновесия реакции KPB=10(-2090/T-2,018)
Константа адсорбции KCO2=1,02*10-6*exp(67439/RT)
Константа адсорбции KH2=2,71*102*exp(-6291/RT)
Константа адсорбции KH2O=3,8*10-10*exp(80876/RT)
1) Начальные мольные доли веществ: водорода — 0,58; CO — 0,06; CO2 — 0,09; вода — 0,27.
2) Давление — 4,5 МПа. Давление остается постоянным.
3) Температура — 220 °С. Температура остается постоянной.
4) Объем — 0,00001 м3.
5) Масса катализатора — 0,0075 кг (из расчета типовой насыпной плотности слоя такого катализатора 750 кг/м3).
Задание:
1. Ознакомьтесь с приближенным (численным) способом решения системы дифференциальных уравнений с использованием метода Эйлера.
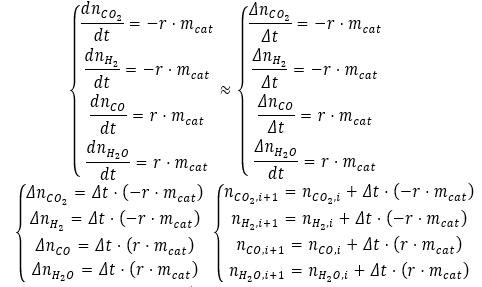
2. С использованием электронных таблиц решите кинетическую модель реакции водяного газа. Выберите как можно меньшее значение шага по времени.
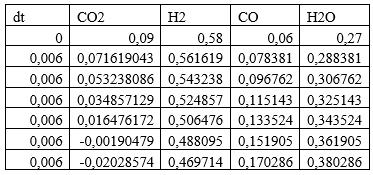
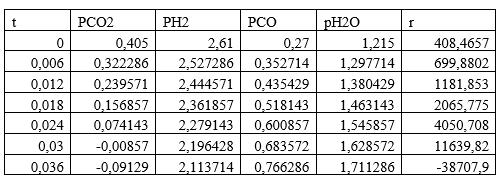
3. Изменяя исходные данные, оцените, в какой момент времени скорость реакции r уменьшается почти до нуля или меняет знак — это соответствует достижению химического равновесия. Какова степень конверсии сырья в этот момент времени? Каков состав смеси?
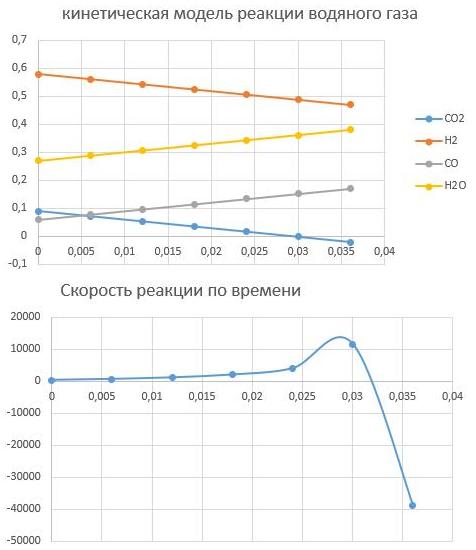
По графикам видно, что скорость останавливается при времени реакции t = 0,032с, при этом равновесный состав Н2 - 0,47; CO — 0,17; CO2 -0; вода — 0,36.Конверсия сырья
αH2=(0,58-0,47)/0,58=0,189=18,9 %
αCO2=(0,09-0)/0,09=1=100%
4. Зная время из п. 3, проведите параметрическое исследование — проварьируйте следу-ющие параметры:
— соотношение CO/CO2 в сырье;
При соотношении CO/CO2 в сырье в начальный момент времени 0,06/0,09 = 0,67
Увеличим CO/CO2 до 0,875, тогда состав станет
Н2 - 0,58; CO — 0,07; CO2 -0,08; вода — 0,27.
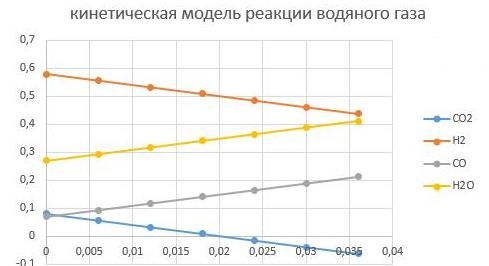
Видно, что так как СО2 стало меньше, то реакции прошла быстрее до полного превраще-ния СО2
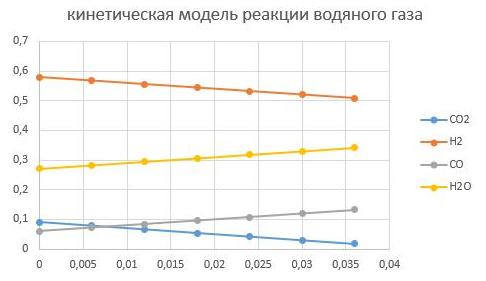
давление Р = 2,5 МПа
давление Р = 6,5 МПа
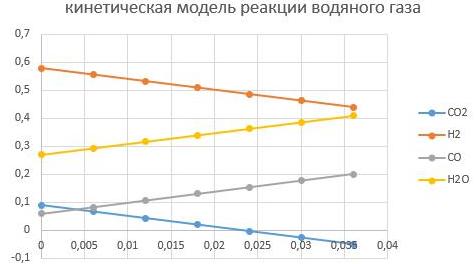
Видно, что увеличение давление способствует интенсифкации реакции
температура в пределах (200–400) °С;
При Т = 200°С
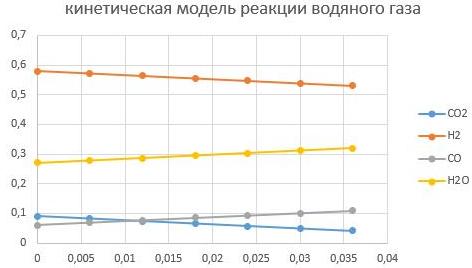
При Т = 400°С
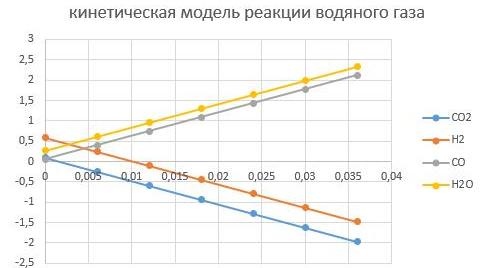
Видно, что увеличение температуры способствует интенсифкации реакции
— масса катализатора в пределах (0,005–0,01) кг.
m_cat=0,005кг
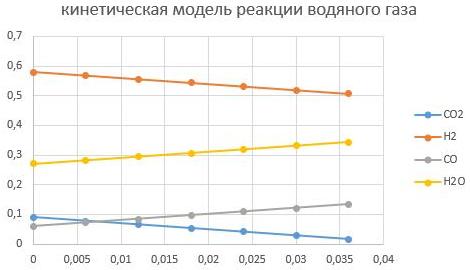
m_cat=0,01кг
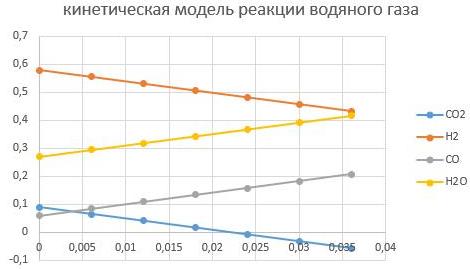
Видно, что увеличение массы катализатора способствует интенсифкации реакции
Часть 2. Система с несколькими реакциями.
Xu и Froment (1989a) [5] предложили для реакций в процессе конверсии водяного пара
СН4 + Н2О = СО + 3Н2 (1)
СО + Н2О = СО2 + Н2 (2)
СН4 + 2Н2О = СО2 + 4Н2 (3)
следующую кинетическую схему:

Используемый 13-ступенчатый механизм показывает конкуренцию за активные центры между метаном и паром.
Выражения для скоростей могут давать немонотонную зависимость скоростей реакций от парциального давления пара и метана.
Кинетическая модель для реакций (1–3) была составлена ими следующим образом:
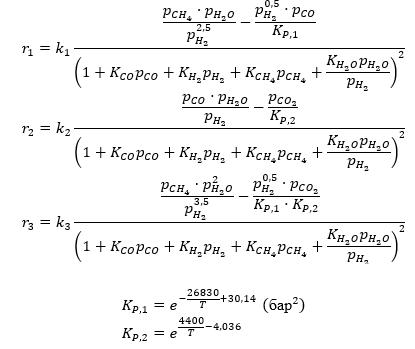
Таблица — Предэкспоненциальные множители для констант скоростей химических реакций, констант адсорбции, энергии активации и теплоты адсорбции
|
Константы |
Предэкспоненциальные множители А |
Энергии активации Ea реакций и теплоты адсорбции Q молекул, кДж/моль |
|
k1, (кмоль бар0,5)/(кг кат-ра ч) |
9,489 · 1015 |
240,10 |
|
k2, кмоль/(кг кат-ра ч бар) |
4,391 · 106 |
67,13 |
|
k3, (кмоль бар0,5)/(кг кат-ра ч) |
2,291 · 1015 |
243,90 |
|
KCO, бар–1 |
8,230 · 10–5 |
70,65 |
|
KCH4, бар–1 |
6,650 · 10–4 |
38,28 |
|
KH2O, бар–1 |
1,770 · 105 |
-88,68 |
|
KH2, бар–1 |
6,120 · 10–9 |
82,90 |
Температурные зависимости констант описываются аррениусовскими уравнениями:
— для констант скоростей ki=Ai⋅exp((-E_(a,i)/RT) )
— для констант адсорбции веществ Ki=Ai⋅exp(Q/RT).
Задание:
1. Повторите графики, полученные в [6, 7] по методу начальных скоростей (Приложение А):
— зависимости скоростей реакций (каждой по отдельности) от парциального давления водяного пара при разных температурах;
— зависимость суммарной скорости превращения метана от парциального давления водяного пара при разных температурах;
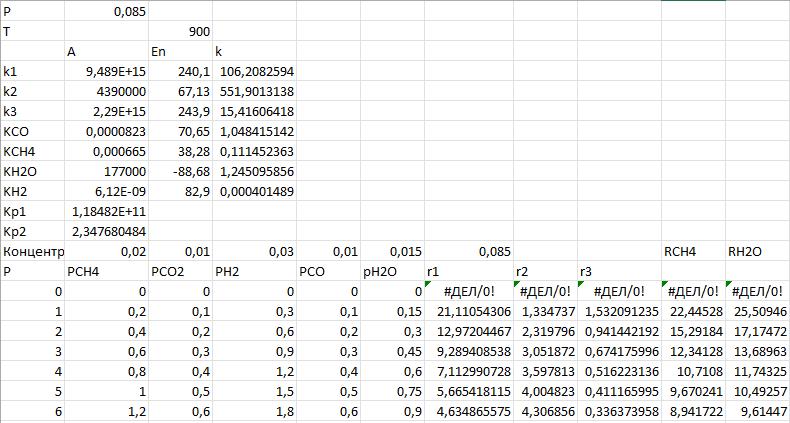
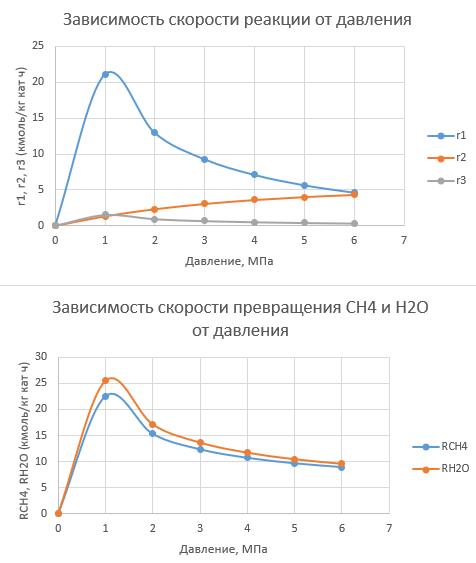
Проанализируйте полученные зависимости. Совпадают ли они с выводами, сделанными при обсуждении данной модели на лекции?
Обратите внимание: исходное парциальное давление пара изменяется, но парциальные давления других компонентов не меняются. Значит, и общее давление должно изменяться, и мольные доли веществ.
Исходные данные используйте из [7]: температуры — 900–1073 К, парциальные давления веществ (кроме водяного пара) — 0,1–0,3 бар.
1. Minji Son, Yesol Woo, Geunjae Kwak, Yun-Jo Lee, Myung-June Park. CFD modeling of a compact reactor for methanol synthesis: Maximizing productivity with increased thermal controllability. International Journal of Heat and Mass Transfer, Volume 145, 2019.


