По Балыбердину вар 3 и 7
Вариант 3 пример 0
Задача 1 (вар 3) Портландцемент получают путем спекания при 1500 ?С шихты, состоящей из глины, огарка и известняка. Состав ингредиентов шихты, мас. доля, %:
глина: SiO2 – 70,0; Al2O3 – 10,0; Н2О – 20,0;
огарок: Fe2O3 – 100,0;
известняк: СаСО3 – 100,0.
Требуется получить портландцемент состава, мас. доля, %: алит (3СаО * SiO2) – 50,0; белит (2СаО * SiO2) – 25,0; трехкальциевый алюминат (3СаО * Al2O3) – 10,0; четырехкальциевый алюмоферрит (4СаО * Al2O3 * Fe2O3) – 15,0. В каких массовых соотношениях необходимо смешать ингредиенты, чтобы выполнить условие Х? Провести расчет на 100 кг шихты.
Скачать решение задачи 1 (вар 3) (цена 70р)
Задача 4 (вар 3) На выходе из контактного аппарата окисления SO2 температура газа составляет Т2, а степень окисления Х. Вычислите температуру Т1 исходной смеси заданного состава:
SO2 + 0,5O2 = SO3; HT = 107,7 кДж/моль.
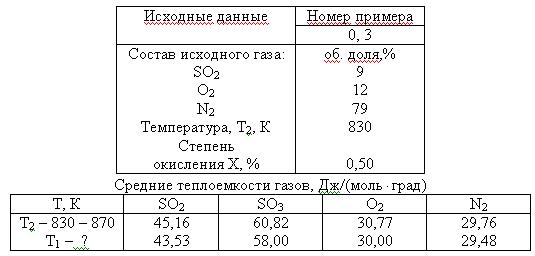
Скачать решение задачи 4 (вар 3) (цена 70р)
Задача 5 (вар 0) Нитрозные газы с содержанием компонентов, об. доля, %: NО – 10; O2 – 8; N2 – остальное, направляются для осуществления реакции оксиления окиси азота до двуокиси азота по реакции
2NO + O2 = 2NO2, (1)
кинетическое уравнение которой соответствует необратимой реакции 3-го порядка, в непрерывно действующий реактор идеального вытеснения при общем давлении 0,2 МПа с целью достижения степени превращения NO в NO2, равной 90% при объемной скорости нитрозных газов (при н. у.), равной 30 000 м3?ч. Рассчитать объем реактора, обеспечивающий указанный процесс, при условии, что его температура и численное значение константы скорости реакции, а также общее давление (в МПа) отвечают номеру примера из таблицы.
Для Варианта 5 условие задачи остается тем же, за исключением общего давления, равного 0,3 МПа.
Температура, 30 С, Значение константы скорости реакции 2,65*10^4
Скачать решение задачи 5 (вар 0) (цена 70р)
Вариант 7 пример 0
Задача 1 (вар 7) Рассчитать массу соляной кислоты, необходимой для перевода карбонатной жесткости в некарбонатную. Чему будет равна после этого некарбонатная жесткость?

Скачать решение задачи 1 (вар 7) (цена 70р)
Задача 2 (вар 7) При выплавке литейного чугуна используют шихту, состоящую из железной руды, кокса и флюса. В каких массовых соотношениях нужно смешать руду, кокс и флюс, чтобы выполнить условие Х, получить чугун с содержанием железа (Fe) – Y (мас. долей) и выдержать модуль основности МО – Z? МО определяется как отношение суммы молей основных оксидов (СаО и MgO) к сумме молей кислых оксидов (SiO2 и Al2O3):
МО = (CaO + MgO) ? (SiO2 + Al2O3).
Состав ингредиентов, мас. доля, %:
железная руда: Fe2O3 – 80,0; CaO – 5,0; MgO – 5,0; Al2O3 – 5,0;
флюс (доломит): СаСО3 – 75,0; MgСО3 – 25,0;
кокс: С – 85,0; СаО – 5,0; SiO2 – 10,0.
Углерод ввести в состав шихты в соответствии со стехиометрией реакции
Fe2O3 + 1,5С = 2Fe + 1,5СО2.
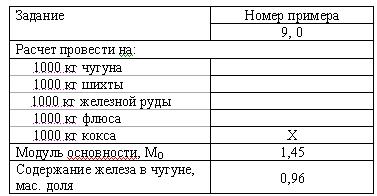
Скачать решение задачи 2 (вар 7) (цена 70р)
Задача 3 (вар 7) Составить материальный баланс получения аммофоса на часовую производительность из экстракционной фосфорной кислоты и газообразного аммиака по следующим реакциям:
H3PO4 + NH3 = NH4H2PO4; (1)
NH4H2PO4 + NH3 = (NH4)2HPO4; (2)
H2SO4 + 2NH3 = (NH4)2SO4; (3)
H2SiF6 + 2NH3 = (NH4)2SiF6. (4)
Реакции (1), (3) и (4) осуществляются до конца. Определить расход фосфорной кислоты и аммиака на 1 т продукта, содержащего 2 % влаги.
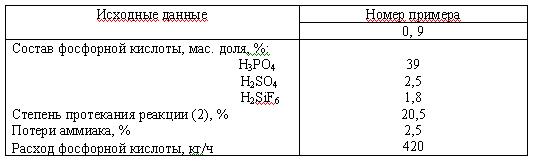
Скачать решение задачи 3 (вар 7) (цена 70р)
Задача 4 (вар 7) Водород получают каталитической конверсией метана:
СН4 + Н2О = СО + 3Н2; HT = 206,2 кДж?моль.
Какое количество тепла необходимо затратить для получения водорода, если потери тепла Х % от прихода? Соотношение СН4 : Н2О = 1 : Y. Температура газов на входе в реактор – Т1, выходящих – Т2, степень конверсии – а, %.
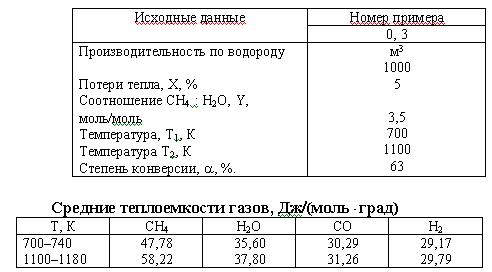
Скачать решение задачи 4 (вар 7) (цена 70р)
Задача 5 (вар 7) Нитрозные газы с содержанием компонентов, об. доля, %: NО – 10; O2 – 8; N2 – остальное, направляются для осуществления реакции оксиления окиси азота до двуокиси азота по реакции
2NO + O2 = 2NO2, (1)
кинетическое уравнение которой соответствует необратимой реакции 3-го порядка, в непрерывно действующий реактор идеального вытеснения при общем давлении 0,2 МПа с целью достижения степени превращения NO в NO2, равной 90% при объемной скорости нитрозных газов (при н. у.), равной 30 000 м3/ч. Рассчитать объем реактора, обеспечивающий указанный процесс, при условии, что его температура и численное значение константы скорости реакции, а также общее давление (в МПа) отвечают номеру примера из таблицы.
Для Варианта 5 условие задачи остается тем же, за исключением общего давления, равного 0,3 МПа.
Температура, 30 С, Значение константы скорости реакции 2,65*10^4
Скачать решение задачи 5 (вар 7) (цена 70р)


