Методичка 120 вопросов
Решение задач 1-30 (методичка 120)
Задача №1.
Перечислите положения квантовой (волновой) механики, на которых основана теория строения электронной оболочки атома.
Что Вы понимаете под квантовым характером излучения и поглощения энергии веществом в микромире?
Приведите электронную конфигурацию атома элемента с порядковым номером 25. Назовите число орбиталей атома этого элемента, имеющих в основном состоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 3d – орбиталей.
Какое максимальное число электронов атома может находится в энергетическом 3d – состоянии.
Скачать решение задачи 1 (методичка 120в) 90р
Задача №2.
Перечислите положения квантовой (волновой) механики, на которых основана теория строения атома.
Что понимают под волновым характером движения микрочастиц?
Приведите электронную конфигурацию а) атома железа и б) иона железа (III).
Укажите число орбиталей атома железа, имеющих в основном состоянии атома по одному электрону.
Опишите форму орбиталей, характеризующихся следующим набором квантовых чисел: n=3; 1=2; m1 = 0, ±1 = ±2
Скачать решение задачи 2 (методичка 120в) 90р
Задача №3.
Перечислите представления квантовой (волновой) механики, на которых основана теория строения атома.
Приведите электронную конфигурацию:
а) атома сурьмы;
б) иона сурьмы (III).
Составьте энергетическую схему распределения по орбиталям электронов атома сурьмы.
Охарактеризуйте набором квантовых чисел 5s – орбиталь. Какое максимальное число электронов может находиться в энергетическом 5p – состоянии?
Скачать решение задачи 3 (методичка 120в) 90р
Задача №4.
Как можно описать состояние электрона в атоме?
Изобразите графически расположение одной s- и трех p- орбиталей относительно осей координат.
Опишите форму орбитали, характеризующейся квантовыми числами: n=6; 1=0; m1=0
Приведите электронную конфигурацию атома бария.
Какое максимальное число электронов может находиться в энергетическом 6p – состоянии?
Скачать решение задачи 4 (методичка 120в) 90р
Задача №5.
На основе представлений квантовой механики сформулируйте понятие «электронное облако».
Какую форму имеют: а) s-орбиталь; б) p-орбиталь? Изобразите их графически.
Приведите электронную конфигурацию атома мышьяка.
Охарактеризуйте набором квантовых чисел каждую из 4p-орбиталей.
Скачать решение задачи 5 (методичка 120в) 90р
Задача №6.
Определите понятие «орбиталь» на основе представлений квантовой (волновой) механики.
Опишите форму орбиталей, характеризующихся квантовыми числами:
n= 4, l=2, m1 =0, ±1, ±2
Приведите электронную конфигурацию атома технеция. Составьте энергетическую схему распределения электронов по орбиталям в атоме технеция.
Укажите суммарное спиновое число 4d-электронов атома технеция.
Скачать решение задачи 6 (методичка 120в) 90р
Задача №7.
Дайте определение понятию «орбиталь» на основе представлений квантовой (волновой) механики.
Постройте модели d- орбиталей.
Приведите конфигурацию атома титана.
Определите число 3d – орбиталей атома титана, не заполненных электронами в основном состоянии отома.
Охарактеризуйте набором квантовых чисел 4s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 4p – состоянии?
Скачать решение задачи 7 (методичка 120в) 90р
Задача №8.
Известно, что орбиталь можно охарактеризовать набором квантовых чисел. Приведите названия квантовых чисел и объясните их физический смысл.
Опишите набором квантовых чисел 3s-орбиталь
Приведите электронную конфигурацию атома рутения.
Составьте энергетическую схему распределения электронов по орбиталям предвнешнего уровня атома рутения. Какое максимальное число электронов может находиться в энергетическом 4d-состоянии?
Скачать решение задачи 8 (методичка 120в) 90р
Задача №9.
Как записывается главное квантовое число?
Для чего оно используется?
Какая из схем отражает распределение электронов по s и p-орбиталям валентной оболочки атома индия:
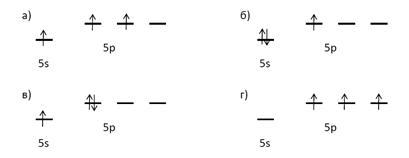
Дайте пояснения к ответу
Составьте электронную конфигурацию иона индия (I)
Охарактеризуйте набором квантовых чисел каждую из 5p-орбиталей. Какое максимальное число электронов может находиться в энергетическом 5d-состоянии?
Скачать решение задачи 9 (методичка 120в) 90р
Задача №10.
Определите понятия: а) энергетический уровень, б) энергетический подуровень. Приведите электронную конфигурацию атома гафния; составьте энергетическую схему распределения электронов по орбиталям предвнешнего уровня атома гафния.
Охарактеризуйте набором квантовых чисел каждую из 5d-орбиталей. В какой последовательности заполняются электронами 4f, 5d, 6s-орбитали?
Скачать решение задачи 10 (методичка 120в) 90р
Задача №11.
1. Приведите обозначение орбитального квантового числа, охарактеризуйте его применение/
2. Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n=1, б) n=2.
3. Атом какого элемента имеет электронную конфигурацию:
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p4
Дайте пояснения
4. Назовите число орбиталей данного атома, имеющих в основном состоянии атома по одному электрону.
Скачать решение задачи 11 (методичка 120в) 90р
Задача №12.
Строение вещества. Электронная оболочка.
Какие значения принимает орбитальное квантовое число для данного квантового числа:
а) n = 3;
б) n = 4?
Какая из электронных конфигураций соответствует иону кобальта (I I).
а) 1s22s22p63s23p63d54s2
б) 1s22s22p63s23p63d74s2
в) 1s22s22p63s23p63d54s0
Составьте энергетическую схему распределения электронов по орбиталям атома кобальта. Охарактеризуйте набором квантовых чисел каждую из 3p-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4p-состоянии?
Скачать решение задачи 12 (методичка 120в) 90р
Задача №13.
Приведите обозначение магнитного квантового числа и объясните его физический смысл.
Чему равно число орбиталей, характеризующихся следующими значениями орбитального квантового числа: а) l = 0, б) l = 1
Приведите электронную конфигурацию йода.
Составьте энергетическую схему распределения электронов по орбиталям атома йода.
Какое максимальное число электронов может находится в энергетическом 4f-состоянии?
Скачать решение задачи 13 (методичка 120в) 90р
Задача №14.
Сформулируйте правило, которым определяется число орбиталей данного энергетического уровня.
Опишите форму орбиталей, характеризующихся квантовыми числами: n = 3, l = 1, ml = 0, ± 1. Как направление p-орбитали вдоль осей координат?
Приведите электронную конфигурацию атома теллура.
Какая из схем отражает распределение электронов по s- и p-орбиталям внешнего уровня в атоме теллура:

Дайте пояснение к ответу.
Какое максимальное число электронов может находиться в энергетическом 5-f состоянии?
Скачать решение задачи 14 (методичка 120в) 90р
Задача №15.
Укажите число орбиталей, характеризующихся значениями орбитального квантового числа: а) l = 2, б) l = 3
Приведите электронную конфигурацию атома сурьмы.
Составьте энергетическую схему распределения электронов по орбиталям атома сурьмы.
Охарактеризуйте набором квантовых чисел каждую из 4f-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4f-состоянии?
Скачать решение задачи 15 (методичка 120в) 90р
Задача №16.
Приведите обозначение спинового квантового числа, объясните его физический смысл.
Приведите электронную конфигурацию атома серы.
Составьте энергетическую схему распределения электронов по орбиталям атома серы.
Охарактеризуйте набором квантовых чисел каждую из 2p-орбиталей.
Скачать решение задачи 16 (методичка 120в) 90р
Задача №17.
Перечислите правила, используемые при составлении электронной конфигурации атома.
Приведите электронную конфигурацию атома олова.
Объясните, как согласно принципу наименьшей энергии, происходит заполнение электронами орбиталей внешнего слоя атома олова.
Рассчитайте значение суммарного спинового числа p-электронов внешнего слоя атома олова.
Охарактеризуйте набором квантовых чисел 7s-орбиталь.
Скачать решение задачи 17 (методичка 120в) 90р
Задача №18.
Приведите правила составление электронной конфигурации атома.
Какова электронная конфигурация атома селена?
Составьте энергетическую схему распределения электронов по орбиталям атома селена.
Объясните, как используют принцип Паули при заполнении электронами внешнего слоя атома селена.
Какой набор квантовых чисел соответствует 2s-орбитали?
Скачать решение задачи 18 (методичка 120в) 90р
Задача №19.
Согласно каким правилам, происходит заполнение электронной оболочки атома?
Назовите элемент с электронной конфигурацией атома:
1s22s22p63s23p63d34s2
Объясните действие правила Гунда при заполнении электронами 3d и 4s-орбиталей данного элемента?
Опишите форму орбиталей, характеризующейся квантовыми числами: n = 4, l = 0, ml = 0.
Какое максимальное число электронов может находится в энергетическом 4p-состоянии?
Скачать решение задачи 19 (методичка 120в) 90р
Задача №20.
Опишите форму орбиталей, характеризующихся следующим набором квантовых чисел: n=4; l=1, ±1.
Правильно ли составлена электронная конфигурация атома висмута:
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p3? При ответе проанализируйте положение висмута в периодической таблице. Составьте энергетическую схему распределения по орбиталям электронов атома висмута.
Чему равно суммарное спиновое число р-электронов внешнего слоя атома висмута?
Какое максимальное число электронов может находиться в энергети-ческом 6d-состоянии?
Скачать решение задачи 20 (методичка 120в) 90р
Задача №21.
Современная формулировка периодического закона Д.И.Менделеева выглядит следующим образом: свойства химических элементов находятся в периодической зависимости от заряда их атомных ядер.
Прокомментируйте выражение: «По мере роста атомного номера элемента периодически повторяются сходные электронные конфигурации валентных электронов, чем и объясняется периодический характер изменения свойств в ряду химических элементов».
Скачать решение задачи 21 (методичка 120в) 90р
Задача №22.
Прокомментируйте выражение: «В периоде закономерно изменяется электронная конфигурация атома, а также значение высшей степени окисления элементов». Поясните сказанное на примере элементов
3 – го периода. Составьте формулы оксидов, отвечающих высшей степени окисления элементов 3 – го периода.
Скачать решение задачи 22 (методичка 120в) 90р
Задача №23.
Охарактеризуйте кислотно-основные свойства оксидов элементов 3-го периода в их высшей степени окисления. В обосновании ответа приведите уравнение реакций взаимодействия оксидов данных элементов с водой (учтите, что некоторые оксиды в воде не растворяются)
Скачать решение задачи 23 (методичка 120в) 90р
Задача №24.
Как вы понимаете выражение: «В периоде при переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств их оксидов». При ответе используйте уравнения реакции взаимодействия оксидов элементов 2-го периода в их высшей степени окисления с водой (учтите, что оксид бериллия в воде не растворяется).
Скачать решение задачи 24 (методичка 120в) 90р
Задача №25.
Прокомментируйте выражение: «Для элементов периода переход от основных к кислотным оксидам и гидроксидам осуществляется через амфотерный оксид и гидроксид».
Подтвердите уравнениями реакций амфотерность оксида и гидроксида алюминия.
Скачать решение задачи 25 (методичка 120в) 90р
Задача №26.
Определите понятия: а) группа химических элементов; б) подгруппа химических элементов. Опишите структуру VII-ой группы периодической таблицы.
Приведите формулы оксидов и гидроксидов хлора и марганца, отвечающих их высшей степени окисления.
Скачать решение задачи 26 (методичка 120в) 90р
Задача №27.
Назовите признак, по которому: а) элементы образуют данную подгруппу; б) элементы формируют данную группу. Ответ дайте на примере IV-ой группы периодической таблицы.
Скачать решение задачи 27 (методичка 120в) 90р
Задача №28.
Укажите элементы VI-ой группы, входящие в: а) в главную подгруппу, б) побочную подгруппу. К s-, p- или d- элементам они относятся? В чем сходство и различие в структуре атомов элементов этих подгрупп? Приведите формулы оксидов 6-ой группы, отвечающих их высшей степени окисления.
Скачать решение задачи 28 (методичка 120в) 90р
Задача №29.
Определите понятие «атомный радиус». Как вы понимаете выражение: «В периодах по мере увеличения заряда радиусы атомов в общем уменьшаются».
Скачать решение задачи 29 (методичка 120в) 90р
Задача №30.
Дайте определение понятию «атомный радиус». Как вы объясните то, что в подгруппах элементов радиусы атомов, в общем увеличиваются?
Скачать решение задачи 30 (методичка 120в) 90р
Решение задач 31-60 (методичка 120)
Задача №31.
Определите понятие – энергия ионизации атома. Почему в периодах с ростом заряда ядра энергия ионизации атом в целом возрастает
Какой из элементов – алюминий или сера – характеризуется большим значением энергии ионизации? Приведите формулу соединения серы с алюминием и назовите его.
Скачать решение задачи 31 (методичка 120в) 90р
Задача №32.
Дайте определение энергии ионизации атома.
Объясните, почему в подгруппах s- и p- элементов с возрастанием атомного номера элементов проявляется тенденция к уменьшению энергии ионизации атомов?
Какой из элементов – фтор или хлор – характеризуется большим значением энергии ионизации?
Составьте формулы соединений хлора с фтором. Назовите эти соединения.
Скачать решение задачи 32 (методичка 120в) 90р
Задача №33.
Перечислите периодические свойства химических элементов. Что понимается под сродством электрона к атому? Как Вы понимаете выражение: «Сродство к электрону зависит от электронной конфигурации атома»?
Скачать решение задачи 33 (методичка 120в) 90р
Задача №34.
Электроотрицательность определяют, как способность атома в соединении оттягивать на себя электронное облако (приобретать отрицательный заряд) от другого атома. Какой из элементов – калий или мышьяк – характеризуется большим значением электроотрицательности? Приведите формулу соединения калия с мышьяком и назовите его.
Скачать решение задачи 34 (методичка 120в) 90р
Задача №35.
Дайте определение понятию электроотрицательность. Почему в периодах наблюдается общая тенденция роста электроотрицательности элементов, а в группах – ее падение? Какие из элементов: а) магний или фосфор; б) кислород или селен характеризуются большим значением электроотрицательности? Составьте формулы соединения а) магния с фосфором; б) кислорода с селеном. Назовите соединения
Скачать решение задачи 35 (методичка 120в) 90р
Задача №36.
Что понимается под а) d-сжатием; б) f-сжатием?
Расскажите о влияние d- и f- сжатия на характер изменения радиусов атомов и энергии ионизации атомов d-элементов.
Скачать решение задачи 36 (методичка 120в) 90р
Задача №37.
Что понимается под степенью окисления элемента?
Назовите высшую и низшую степени окисления элементов: азота, серы, хлора, углерода, фосфора, кремния.
Составьте формулы соединения перечисленных элементов, а их высших и низших степенях окисления с кислородом и водородом. Назовите соединения
Скачать решение задачи 37 (методичка 120в) 90р
Задача №38.
В подгруппах p-элементов с ростом атомного номера уменьшается устойчивая положительная степень окисления.
Назовите устойчивые положительные степени окисления азота и висмута. Приведите примеры соединения азота и висмута, отвечающие их устойчивым степеням окисления.
Скачать решение задачи 38 (методичка 120в) 90р
Задача №39.
В подгруппах d-элементов с ростом атомного номера увеличивается положительная степень окисления. Назовите устойчивые положительные степени окисления марганца и рения. Приведите примеры соединения марганца и рения, отвечающие их устойчивым степеням окисления.
Скачать решение задачи 39 (методичка 120в) 90р
Задача №40.
Объясните тот факт, что при одинаковой электронной конфигурации внешнего слоя атомов углерод и свинец отличаются по свойствам.
Скачать решение задачи 40 (методичка 120в) 90р
Задача № 41а.
Воспользовавшись энергетической диаграммой молекулярных орбиталей двухатомных молекул элементов 2-го периода. Почему молекула кислорода парамагнитна (обладает магнитными свойствами)? Определите порядок связи в этой молекуле.
Скачать решение задачи 41а (методичка 120в) 45р
Задача № 41б.
Объясните образование химической связи в молекуле аммиака, используя метод валентных связей. Опишите пространственную конфигурацию молекулы аммиака, пользуясь моделью отталкивания электронных пар.
Скачать решение задачи 41б (методичка 120в) 45р
Задача №42а.
Используя энергетическую диаграмму молекулярных орбиталей двухатомных молекул и ионов элементов 2-го периода, распределите валентные электроны по орбиталям гетероядерного иона . Обладает ли данный ион магнитными свойствами? Каков порядок связи в цианид-ионе?
Скачать решение задачи 42а (методичка 120в) 45р
Задача №42б.
В представлении теории валентных связей химическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная (связь называют ковалентной химической связью).
Объясните образование ковалентной связи в молекуле метана, используя метод валентных связей.
Опишите пространственную конфигурацию молекулы метана, используя модель отталкивания электронных пар.
Скачать решение задачи 42б (методичка 120в) 45р
Задача №43а.
Распределите валентные электроны молекулы фтора по энергетической диаграмме молекулярных орбиталей двухатомных молекул 2-го периода. Определите порядок связи в молекуле. Обладает ли молекула фтора магнитными свойствами?
Скачать решение задачи 43а (методичка 120в) 45р
Задача №43б.
Согласно теории валентных связей, в образовании ковалентных связей могут принимать участие одноэлектронные облака (один из механизмов образования ковалентной связи). Опишите данный механизм на примере образования ковалентной связи между атомами фтора.
Определите пространственную конфигурацию молекулы OF2, используя модель отталкивания электронных пар.
Скачать решение задачи 43б (методичка 120в) 45р
Задача №44а.
Используя энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода, распределите валентные электроны по орбиталям молекулы азота. Определите порядок связи в молекуле азота? Как порядок связи в молекуле азота влияет на энергию связи (известно, что эта молекула химически малоактивна)?
Скачать решение задачи 44а (методичка 120в) 45р
Задача №44б.
Согласно донорно-акцепторному механизму, ковалентная связь образуется за счет взаимодействия частиц, одна из которых имеется пару электронов (донор), а другая – свободную орбиталь (акцептор).
Объясните образование иона аммония при взаимодействии молекулы аммиака с протоном NH3 + H+ = NH4+. Опишите пространственную конфигурацию иона аммония. Используйте при ответе модель отталкивания электронных пар.
Скачать решение задачи 44б (методичка 120в) 45р
Задача №45а.
Используя энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода, рассчитайте порядок связи в молекуле кислорода и в его молекулярном ионе O22-.
Как изменится энергия связи в пероксид-ионе по сравнению O22-с молекулой с изменением порядка связи?
Скачать решение задачи 45а (методичка 120в) 45р
Задача №45б.
Объясните образование ковалентной связи в молекуле азота согласно методу валентных связей.
Что понимают под σ (сигма) - и π (пи) - связями? Покажите это на примере образования связи в молекуле азота.
С помощью модели отталкивания электронных пар опишите пространственную конфигурацию молекулы
Скачать решение задачи 45б (методичка 120в) 45р
Задача №46а.
Используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул и молекулярных ионов, образованных элементами 1-го периода, при ответе на вопрос об изменение энергии связи и ее длины в ряду
Скачать решение задачи 46а (методичка 120в) 45р
Задача №46б.
При помощи модели отталкивания электронных пар объясните структуру молекулы силана SiH4
Скачать решение задачи 46б (методичка 120в) 45р
Задача №47а.
Распределите валентные электроны по орбиталям молекулы кислорода и молекулы азота согласно энергетической диаграмме молекулярных орбиталей двухатомных молекул элементов 2-го периода.
Обоснуйте, почему энергия диссоциации на атомы молекул меньше, чем молекул N2.
Энергия диссоциации N2 = 945 кДж/моль, O2= 498 кДж/моль
Скачать решение задачи 47а (методичка 120в) 45р
Задача №47б.
Согласно теории валентных связей ковалентные, связи обуславливаются не только валентными электронами, но и валентными орбиталями. В представлениях теории валентных связей объясните состав иона аммония.
Опишите пространственную конфигурацию молекулы на основе метода отталкивания электронных пар.
Скачать решение задачи 47б (методичка 120в) 45р
Задача №48а.
Используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода при распределении валентных электронов по орбиталям молекулы C2.
Объясните последовательность заполнения орбиталей электронами в молекуле C2.
Рассчитайте порядок связи в этой молекуле. Установите, является ли молекула парамагнитной C2либо диамагнитной?
Скачать решение задачи 48а (методичка 120в) 45р
Задача №48б.
Объясните состав молекулы BH3 и иона [BH4]- в рамках представлений теории валентных связей о механизмах образования ковалентной связи.
Опишите пространственную конфигурацию гидридоборат-иона [BH4]-, пользуясь моделью отталкивания электронных пар.
Скачать решение задачи 48б (методичка 120в) 45р
Задача №49а.
Опишите применение принципа наименьшей энергии при распределении валентных электронов по молекулярным орбиталям молекулы B2 (используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода). Определите порядок связи в этой молекуле.
Почему молекула B2 не обладает магнитными свойствами (является диамагнитной)?
Скачать решение задачи 49а (методичка 120в) 45р
Задача №49б.
Согласно методу валентных связей рассмотрите валентные возможности атома бора на примере образования молекулы BH3 и иона [BH4]-. Опишите пространственную конфигурацию молекулы BH3, пользуясь моделью отталкивания электронных пар.
Скачать решение задачи 49б (методичка 120в) 45р
Задача №50а.
Опишите применение принципа Паули при распределении валентных электронов по орбиталям молекулярного иона O2- (используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода). Определите порядок связи в этом ионе.
Объясните тот факт, что энергия диссоциации иона O2- меньше энергии диссоциации молекулы O2
Энергия диссоциации O2 = 498 кДж/моль, O-2 = 394 кДж/моль
Скачать решение задачи 50а (методичка 120в) 45р
Задача №50б.
Примените метод валентных связей при определении пространственной конфигурации BeH2 и [BeH4]2-.
Скачать решение задачи 50б (методичка 120в) 45р
Задача №51а.
Как применяется правило Гунда при распределении валентных электронов по орбиталям молекулярного гетероядерного иона CN+ (используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода)? Определите порядок связи в этом ионе.
Объясните тот факт, что энергия диссоциации иона CN+ меньше энергии диссоциации иона CN-.
Энергия диссоциации, CN+ = 439 кДж/моль, CN-= 1003 кДж/моль,
Скачать решение задачи 51а (методичка 120в) 45р
Задача №51б.
Примените метод валентных связей для объяснения состава молекулы H2O и иона H3O+.
Опишите пространственную конфигурацию молекулы H2O, пользуясь моделью отталкивания электронных пар.
Скачать решение задачи 51б (методичка 120в) 45р
Задача №52а.
Длиной химической связи называют расстояние между ядрами, при котором энергия системы минимальна. Энергией связи называют энергию, необходимую для разрыва связи между атомами.
По энергетическим диаграммам молекулярных орбиталей систем O2, O2- и O22- охарактеризуйте изменение энергии связи и длины связи в ряду
Ответ обоснуйте.
Какая из данных систем не обладает магнитными свойствами (является диамагнитной)?
Скачать решение задачи 52а (методичка 120в) 45р
Задача №52б.
Пространственную конфигурацию молекул можно определить с помощью модели отталкивания валентных электронных пар. По этой модели число σ (сигма) - электронных пар центрального атома влияет на расположение вокруг него химических связей и периферических атомов. За счет взаимного отталкивания σ - электронные пары располагаются в максимальной удаленности друг от друга.
Опишите пространственную конфигурацию молекулы ВF3.
Определите пространственную конфигурацию молекул при числе
σ - электронных пар центрального атома равном: а) двум; б) трем; в) четырем; г) шести.
Скачать решение задачи 52б (методичка 120в) 45р
Задача №53а.
Используйте энергетическую диаграмму молекулярных орбиталей двухатомных молекул элементов 2-го периода при распределении валентных электронов гетероядерной молекулы оксида углерода (II).
Обоснуйте, почему молекула является: а) одной из самых прочных молекул (ее энергия диссоциации составляет 1069 кДж/моль)
б) диамагнитной (не обладает магнитными свойствами)
Скачать решение задачи 53а (методичка 120в) 45р
Задача №53б.
Опишите пространственную конфигурацию молекулы PF3, в представлениях теории валентных связей.
Каково влияние не связывающих электронных пар центрального атома на геометрию молекулы?
Скачать решение задачи 53б (методичка 120в) 45р
Задача №54а.
Используя энергетические диаграммы орбиталей двухатомных молекул элементов 2-го периода, объясните, почему в ряду N2-O2-F2 прочность химической связи уменьшается, а ее длина увеличивается.
N2 O2 F2
Энергия диссоциации, кДж/моль, 945 498 159
Межъядерное расстояние, нм 0,110 0,121 0,141
Скачать решение задачи 54а (методичка 120в) 45р
Задача №54б.
Согласно модели отталкивания валентных электронных пар наличие в молекуле не связывающих электронных пар влияет на геометрию молекулы.
Опишите пространственную конфигурацию молекулы (у атома азота - три связывающие электронные пары и одна не связывающая).
Скачать решение задачи 54б (методичка 120в) 45р
Задача №55а.
Объясните изменение порядка и энергии связи молекул ряда O2-NO-N2 используя энергетические диаграммы орбиталей двухатомных молекул элементов 2-го периода. Какие из молекул обладают магнитными свойствами?
O2 NO N2
Энергия диссоциации, кДж/моль 498 632 945
Межъядерное расстояние, нм 0,121 0,116 0,110
Скачать решение задачи 55а (методичка 120в) 45р
Задача №55б.
Примените теорию валентных связей для объяснения состава молекулы CO2. Опишите пространственную конфигурацию молекулы CO2, пользуясь моделью отталкивания валентных электронных пар.
Скачать решение задачи 55б (методичка 120в) 45р
Задача №56а.
По энергетическим диаграммам молекулярных орбиталей двухатомных молекул элементов 2-го периода, определите, какая из систем – NO или - NO+ обладает наибольшей устойчивостью. Ответ сопоставьте с данными:
Энергия диссоциации NO = 632 кДж/моль, NO+ = 1046кДж/моль
Обоснуйте сделанные выводы.
Какая из этих систем является парамагнитной?
Скачать решение задачи 56а (методичка 120в) 45р
Задача №56б.
Пространственную конфигурацию молекул можно определить с помощью модели гибридизации валентных орбиталей.
Назовите пространственную конфигурацию молекул, если валентные орбитали атомов находятся в состоянии: а) sp - гибридизации, б) sp2-гибридизации, в) sp3-гибридизации, г) sp2d2-гибридизации.
В рамках теории гибридизации валентных орбиталей центрального атома, объясните, почему молекулы метана имеет форму тетраэдра.
Скачать решение задачи 56б (методичка 120в) 45р
Задача №57а.
Используя энергетические диаграммы орбиталей двухатомных молекул элементов 2-го периода охарактеризуйте изменение энергии и длины связи в ряду: F2+ - F2 - F2-
Выводы сопоставьте с данными:
F2+ F2 F2-
Энергия диссоциации, кДж/моль 320 159 117
Межъядерное расстояние, нм 0,133 0,141 -
Дайте пояснение к ответу.
Скачать решение задачи 57а (методичка 120в) 45р
Задача №57б.
Используя представления о гибридизации валентных орбиталей атома, определите пространственную конфигурацию молекулы аммиака.
Скачать решение задачи 57б (методичка 120в) 45р
Задача №58а.
По энергетическим диаграммам орбиталей двухатомных молекул элементов 2-го периода определите изменение энергии диссоциации и межъядерного расстояния в гетероядерных системах при переходе от к
Выводы сопоставьте с данными:
Энергия диссоциации, СO = 1076 кДж/моль, CO+ = 805 кДж/кг
Какая из этих систем парамагнитна? Поясните свой ответ.
Скачать решение задачи 58а (методичка 120в) 45р
Задача №58б.
Что означает понятия: а) полярная ковалентная связь, б) неполярная ковалентная связь?
Примените представления о гибридизации валентных орбиталей атом углерода для объяснения строения молекулы CS2.
Скачать решение задачи 58б (методичка 120в) 45р
Задача №59а.
Пользуясь энергетическими диаграммами орбиталей двухатомных молекул элементов 2-го периода, объясните, почему в молекулярном ионе Q2+ энергия связи, больше чем в молекуле O2, тогда как в молекулярном ионе N2+ энергия связи меньше, чем в молекуле N2
O2 Q2+ N2 N2+
Энергия диссоциации, кДж/моль 498 643 945 843
Поясните свой ответ.
Какие из этих систем являются парамагнитным?
Скачать решение задачи 59а (методичка 120в) 45р
Задача №59б.
Опишите особенности: а) ковалентной связи, б) ионной связи, в) металлической связи.
Карбонат-ион CS32имеет форму плоского треугольника. Как можно объяснить этот экспериментальный факт?
Скачать решение задачи 59б (методичка 120в) 45р
Задача №60а.
По энергетическим диаграммам орбиталей двухатомных молекул элементов 2-го периода предскажите, для какой из молекул – O2 или NO - следует ожидать более прочной связи.
Выводы сопоставьте с данными:
Энергия диссоциации, O2 = 498 кДж/моль, NO = 632 кДж/моль.
Ответ поясните.
Являются ли эти молекулы парамагнитными?
Скачать решение задачи 60а (методичка 120в) 45р
Задача №60б.
Что означает понятие - водородная связь?
Каково максимальное число водородных связей, которое может образовать молекула воды?
Опишите пространственную конфигурацию молекулы Н2О, используя: а) модель отталкивания валентных электронных пар; б) модель гибридизации валентных орбиталей центрального атома.
Скачать решение задачи 60б (методичка 120в) 45р
Решение задач 61-90 (методичка 120)
Задача №61.
Дайте ответ на вопросы: а) почему химические реакции сопровождаются энергетическими изменениями; б) почему в ходе реакции изменяется энтропия системы?
Сформулируйте ответ, используя уравнения реакции:
2H2(г) + O2(г) = 2H2О(г), ΔН0298 = -484 кДж; ΔS0298 = -87 кДж
Воспользуйтесь приведенными данными для расчета изменения энергии Гиббса и заключения о возможности протекания реакции горения водорода в стандартных условиях.
Скачать решение задачи 61 (методичка 120в) 90р
Задача № 62.
При изобарном процессе тепловой эффект реакции определяется как изменение энтальпии реакции системы
CaO(к) + CO2(г) = CaCO3(к)
ΔН0f,298, кДж/моль -635 -393 -1207
ΔS0f,298, кДж/моль 40 214 93
в стандартных условиях
Как изменяется энтропия в приведенной реакции?
Подтвердите свой вывод расчетами.
Оцените возможность самопроизвольного протекания данной реакции в стандартных условиях на основе значений ΔН0f,298, ΔS0f,298 , ΔG0f,298
Скачать решение задачи 62 (методичка 120в) 90р
Задача № 63
Чем отличается термохимическое уравнение реакции от обычного уравнения реакции?
Составьте термохимическое уравнение реакции
2KClO3(к) = 2KCl(к) + 3O2(г)
ΔН0f,298, кДж/моль -391 -436 0
ΔS0f,298, кДж/моль 143 83 205
Каков знак изменения энтропии в приведенной реакции? Подтвердите ответ соответствующими расчетами. Объясните, почему этот процесс необратим.
Скачать решение задачи 63 (методичка 120в) 90р
Задача №64.
При протекании экзотермической реакции энтальпия системы уменьшается . К таким процессам: экзо- или эндотермическим относятся реакции:
а) H2(г) + 3H2(г) = 2 NH3(г)
ΔН01,298 кДж/моль 0 0 -46
б) СаСО3 (к) = СаО (к) + СО2 (г)
ΔН0f,298, кДж/моль -1207 -635 -393
ΔS0f,298, кДж/моль 93 40 214
Вычислите ΔS0f,298, ΔG0f,298 реакции разложения карбоната кальция. Определите, возможна ли реакция при 298 K.
Рассчитайте температуру, при которой процесс разложения СаСО3может протекать произвольно.
Скачать решение задачи 64 (методичка 120в) 90р
Задача №65.
Для сравнения энергетических эффектов различных процессов расчеты относят к условиям, принятым за стандартные. Какие условия считаются стандартными? Какую информацию содержат обозначения: ΔH0f,298, ΔS0f,298, ΔG0f,298, ΔH0f,298, ΔG0f,298,
Вычислите ΔH0f,298 реакции, протекающей в термите (термит-порошкообразная семь алюминия и оксида менее активного металла (Fe, Mn и др.))
3Fe3O4(к) + 8Al(к) = 4Al2O3(к) + 9Fe(к)
ΔН0f,298, кДж/моль -1117 0 -1676 0
ΔS0f,298, кДж/моль 146 28 51 27
Составьте термохимическое уравнение реакции (обратите внимание на величину теплового эффекта реакции).
Пользуясь значениями ΔH0f,298, ΔS0f,298, ΔG0f,298 объясните, может ли приведенная реакция протекать самопроизвольно в стандартных условиях?
Скачать решение задачи 65 (методичка 120в) 90р
Задача №66.
Что понимают под стандартной молярной энтальпией образования веществ ΔH0f,298?
Используя значения ΔH0f,298 веществ, рассчитайте изменение энтальпии реакции
3Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г)
ΔН0f,298, кДж/моль -1117 110 -265 -393
ΔS0f,298, кДж/моль 146 197 61 214
а) вычислите ΔG0f,298 процесса и сделайте вывод о возможности его самопроизвольного протекания в стандартных условиях.
б) определите температуру, при которой этот процесс становится самопроизвольным.
Скачать решение задачи 66 (методичка 120в) 90р
Задача №67.
Согласно закону Гесса, тепловой эффект реакции равен сумме молярных энтальпий образования продуктов реакции за вычетом суммы молярных энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов).
Для стандартных условий
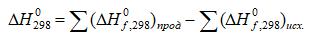
Вычислите реакции ΔН0f,298
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
ΔН0f,298, кДж/моль -46 0 90 -242
ΔS0f,298, кДж/моль 193 205 211 189
и составьте ее термохимическое уравнение.
Определите вклад энтальпийного (ΔН) и энтропийного (TΔS) факторов в осуществление приведенной реакции.
Объясните, почему данных процесс необратим. При ответе используйте значения ΔH0f,298, ΔS0f,298, ΔG0f,298
Скачать решение задачи 67 (методичка 120в) 90р
Задача №68.
Что понимают под стандартной молярной энтропией? В каких единицах оно измеряется?
Выскажите предположение о характере изменения энтропии (ΔS>0, ΔS<0, ΔS=0)) в процессах:
2KClO3(к) = 2KCl(к) + 3O2(г) ΔH0f,298 =-90
ΔS0f,298, кДж/моль 143 83 205
2С2H2(г) + 5О2(г) = 4СO2(г) + 2Н2О
ΔS0f,298, кДж/моль 201 205 214 70
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
Для обоснования ответа рассчитайте изменение энтропии в этих реакциях.
Отметьте, какую информацию содержит уравнение реакции разложения KClO3. Вычислите ΔG0f,298 данной реакции. Будет ли она самопроизвольно протекать в стандартных условиях?
Скачать решение задачи 68 (методичка 120в) 90р
Задача №69.
Энтропию можно рассматривать как меру «беспорядка» (неупорядоченности) системы. Сравните значения стандартной молярной энтропии воды в газовом, жидком и кристаллическом состояниях:
H2O(г) Н2О(ж) Н2О(к)
ΔS0f,298, кДж/моль 189 70 39
Объясните различия значений ΔS0f,298, воды в ее различных агрегатных состояниях.
Вычислите изменения энтропии и энергии Гиббса реакции:
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г) ΔH0f,298 =96
ΔS0f,298, кДж/моль 87 130 27 189
и определить возможность ее осуществления в стандартных условиях.
Скачать решение задачи 69 (методичка 120в) 90р
Задача №70.
1. Энтропия является количественной мерой беспорядка в системе. Энтропия растет при плавлении твердого вещества и превращении жидкости в пар, при процессах растворения кристаллического вещества и в химических реакциях, протекающих с увеличением объема. Процессы, связанные с ростом упорядоченности системы (охлаждение, конденсация, кристаллизация из раствора, сжатие и пр.) сопровождаются уменьшением энтропии. Чем тверже вещество, тем меньше его энтропия.
Объясните: а) какой из металлов является более мягким?
Be Mg Ca
ΔS0f,298, кДж/моль 9,5 32,7 41,6
б) почему стандартная молярная энтропия у алмаза меньше (2,3 Дж/К ⋅ моль), чем у графита (5,7 Дж/К ⋅ моль)?
2. Отметьте, какую информацию содержит уравнение
2Pb(к) + O2(г) = 2PbO(к) ΔH0f,298 = -438 кДж
ΔS0f,298, кДж/моль 65 205 66
Рассчитайте ΔS0f,298, ΔG0f,298, данной реакции и определите осуществима ли она в стандартных условиях.
Скачать решение задачи 70 (методичка 120в) 90р
Задача №71.
Энтропия возрастает (ΔS>0) при переходе системы из более упорядоченного состояния в менее упорядоченное и, наоборот, переход системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии (ΔS<0).
Объясните характер изменения энтропии (ΔS>0, ΔS<0, ΔS=0) в следующих превращениях:
(NH4)2CO3(к) = 2NH3(г) + СO2(г) + H2O(г)
2HCl(г) = H2(г) + Cl2(г)
PCl3(г) + Cl2(г) = PCl3(г)
ΔН0f,298, кДж/моль -287 0 -366
ΔS0f,298, кДж/моль 312 223 365
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
PCl5(г) = Cl2(г) + PCl3(г)
Вычислите ΔH0f,298, ΔS0f,298, ΔG0f,298 последней реакции.
а) определите вероятность ее протекания в стандартных условиях.
б) рассчитайте температуру начала разложения хлорида фосфора (V).
Скачать решение задачи 71 (методичка 120в) 90р
Задача №72
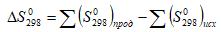
Изменение энтропии системы зависит от ее начального и конечного состояний. Изменение энтропии при химических реакциях равно сумме энтропии продуктов реакции за вычетом суммы энтропии исходных веществ (с учетом стехиометрических коэффициентов).
Для стандартных условий изменение энтропии имеет вид.
Вычислите изменение энтропии в реакциях:
2С2H2(г) + 5O2(г) = 4СO2(г) + 2H2O(ж)
ΔН0f,298, кДж/моль 227 0 -393 -286
ΔS0f,298, кДж/моль 201 205 214 70
COCl2(г) = СO2(г) + Cl2(г)
ΔS0f,298, кДж/моль 284 214 223
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
Рассчитайте ΔH0f,298, ΔS0f,298, для первой реакции и установите, будет ли она самопроизвольной в стандартных условиях.
Скачать решение задачи 72 (методичка 120в) 90р
Задача №73.
В самопроизвольно протекающих процессах действуют две тенденции: а) стремление частиц к объединению за счет образования более прочных связей, что сопровождается уменьшением энтальпии (ΔH<0);
б) стремление частиц к разъединению, что увеличивает энтропию ΔS>0.
Суммарный эффект этих противоположных тенденций отражает изменение энергии Гиббса.
Рассчитайте изменение энергии Гиббса ΔG0f,298 реакции:
C(графит,к) + 2H2(г) = CH4(г)
ΔН0f,298, кДж/моль 0 0 75
ΔS0f,298, кДж/моль 6 130 186
рассчитав предварительно значения ΔH0f,298, ΔG0f,298
Установите, осуществима ли эта реакция в стандартных условиях. Отметьте, какой фактор – энтальпийный ΔH или энтропийный TΔS - определяет возможность самопроизвольного протекания прямой реакции? Объясните, может ли повышение температуры изменить направление реакции?
Скачать решение задачи 73 (методичка 120в) 90р
Задача №74.
Прокомментируйте утверждение, что характер изменения энергии Гиббса, является критерием направления протекания химической реакции.
Проиллюстрируйте использование ΔG0f,298 для возможности протекания реакции разложения карбоната магния в стандартных условиях.
MgCO3(к) = MgO(k) + CO2(к)
ΔН0f,298, кДж/моль -1113 -602 -293
ΔS0f,298, кДж/моль 66 27 214
Рассчитайте изменение энергии Гиббса, используя значения и ΔH0f,298, ΔS0f,298. Определите значение температуры, при которой становится возможной термическая диссоциация карбоната магния.
Скачать решение задачи 74 (методичка 120в) 90р
Задача №75.
Справедливо ли утверждение, что изменение свободной энергии Гиббса является критерием самопроизвольности протекания процесса?
Обоснуйте, могу ли реакции
N2(г) + O2(г) = 2NO(г) ΔH0f,298 = 180 кДж ΔS0f,298 = 17 кДж
NH3(г) + HCl(г) = NH4Cl(k)
ΔН0f,298, кДж/моль -47 -92 -314
ΔS0f,298, кДж/моль 193 187 96
Идти самопроизвольно в стандартных условиях. Вычислите ΔG0f,298,
реакции, используя значения ΔH0f,298, ΔS0f,298,
Поясните, какой фактор – энтальпийный (ΔH) или энтропийный TΔS, определяет знак ΔG0f,298 реакции образования хлорида аммония? Экзо- или эндотермическим процессом является эта реакция?
Скачать решение задачи 75 (методичка 120в) 90р
Задача №76.
Сформулируйте понятие стандартной молярной энергии Гиббса образования вещества.
По известным значениям ΔG0f,298 рассчитайте изменения энергии Гиббса (ΔG0298) следующих процессов:
TiO2(k) + 2C(k) = Ti(k) + 2CO(г)
ΔG0f,298, кДж/моль -889 0 0 -137
CH4(г) + 2O2(г) = СO2(г) + 2H2O(ж)
ΔG0f,298, кДж/моль -51 0 -394 -237
ΔH0f,298, кДж/моль -75 0 -393 -286
C2H4(г) + 3O2(г) = 2СO2(г) + 2H2O(ж)
ΔG0f,298, кДж/моль 68 0 -394 -237
ΔH0f,298, кДж/моль 52 0 -393 -286
Отметьте будут ли они протекать самопроизвольно в стандартных условиях.
Составьте термохимические уравнения реакции горения метана и этилена. Какое из этих веществ наиболее выгодно использовать в качестве топлива?
Скачать решение задачи 76 (методичка 120в) 90р
Задача №77.
Согласно закону Гесса, изменение энергии Гиббса реакции равно сумме молярных энергий Гиббса образования продуктов реакции за вычетом суммы молярных энергий Гиббса образования исходных веществ (с учетом стехиометрических коэффициентов) Для стандартных условий
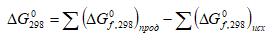
На основе значений ΔG0f,298 рассчитайте изменение энергии Гиббса в системе
CH4(г) + CO2(г) = 2СO(г) + 2H2(г)
ΔH0f,298, кДж/моль -75 -393 -110 0
ΔS0f,298, кДж/моль 186 214 198 130
ΔG0f,298, кДж/моль -51 -394 -137 0
Проведя соответствующие расчеты, обсудите вопросы:
1. Возможно ли самопроизвольное протекание прямой реакции при 25°C?
2. Экзо- или эндотермической является реакция?
3. Уменьшится или увеличится энтропия (ΔS<0 или ΔS>0) в данном процессе?
4. Энтальпийный (ΔH) или энтропийный (TΔS) фактор определяет значение ΔG0f,298?
Скачать решение задачи 77 (методичка 120в) 90р
Задача №78.
Изменение энергии Гиббса зависит от изменения энтальпии, энтропии и температуры:
ΔG = ΔH - TΔS
Соотношений значений ΔH (энтальпийный фактор) и TΔS (энтропийный фактор) определяет направление (прямое или обратное) течение химического процесса:
1. ΔH<0, ΔS>0, ΔG<0 - прямая реакция возможна при любой температуре.
2. ΔH<0, ΔS<0, ΔG<0 - прямая реакция возможна при низкой температуре.
3 ΔH>0, ΔS>0, ΔG<0 - прямая реакция возможна при высокой температуре.
4. ΔH>0, ΔS<0, ΔG>0 - обратная реакция возможна при любой температуре.
Для приведенных процессов:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2O(г)
4NH3(г) + 5О2(г) = 4NО(г) + 6H2O(г)
ΔH0f,298, кДж/моль -46 0 90 -242
ΔS0f,298, кДж/моль 193 205 211 189
Определите:
1) какая из реакций окисления аммиака термодинамически наиболее вероятна?
2) обратима ли реакция окисления аммиака кислородом, осуществляемая в производстве азотной кислоты?
Скачать решение задачи 78 (методичка 120в) 90р
Задача №79.
Как вы понимаете утверждение, что свободная энергия Гиббса образования химического соединения является мерой устойчивости этого соединения?
Рассчитайте изменения энергии Гиббса реакции:
H2(г) + F2(г) = 2HF(г)
ΔG0f,298, кДж/моль 0 0 -273
H2(г) + Cl2(г) = 2HCl(г)
ΔG0f,298, кДж/моль 0 0 -95
ΔH0f,298, кДж/моль 0 0 -95
ΔS0f,298, кДж/моль 130 223 187
H2(г) + Br2(г) = 2HBr(г)
ΔG0f,298, кДж/моль 0 0 -51
H2(г) + I2(г) = 2HI(г)
ΔG0f,298, кДж/моль 0 0 2
и установите: а) какая из них в стандартных условиях термодинамически наиболее вероятна; б) какое из образовавшихся веществ является наиболее устойчивым (заметим, что положительное значение ΔG0298 в реакции образования HI свидетельствует о том, что данное соединение малоустойчиво и легко разлагается на H2 и I2).
Для реакции синтеза рассчитайте ΔH0f,298, ΔS0f,298
а) сопоставьте абсолютные значения ΔH и TΔS, сделайте заключение о влияние энтальпийного и энтропийного факторов ΔG0298
б) установите, является ли данная реакция экзо- или эндотермической
Скачать решение задачи 79 (методичка 120в) 90р
Задача №80.
На основе значений ΔH0f,298, ΔS0f,298 и ΔG0f,298 определите, какие из приведенных реакций термодинамически более вероятны в стандартных условиях:
TiO3(k) + 3C(графит) = TiC(k) + 2CO(г)
TiO2(k) + 2C(графит) = Ti(k) + 2CO(г)
TiO2(k) + 2Cl(г) = TiCl4(ж) + O2(г)
TiO2(k) + 2Cl2(г) = TiCl4(ж) + 2CO(г)
TiO2(k) TiC(k) Ti(k) TiCl4(ж) С(граф) СО(г) Сl2(г) С2(г)
ΔH0f,298, кДж/моль -944 -209 0 -804 0 -110 0 0
ΔS0f,298, кДж/моль 50 25 31 252 6 197 223 205
Обсудите: а) как повлияет повышение температуры на вероятность осуществления каждой из реакций.
б) почему при промышленном способе получения титана диоксид титана превращают в (последняя реакция)? Далее получают титан по схеме:
TiCl4 + Mg = MgCl2+ Ti
Скачать решение задачи 80 (методичка 120в) 90р
Задача №81.
Сущность процесса гидролиза карбоната натрия выразите записью ионного уравнения.
Na2CO3 + H2O = NaHCO3 + NaOH
Приведите выражение константы гидролиза по карбонат-иону.
Определите направление смещения равновесия гидролиза при увеличении концентрации в растворе гидроксид-ионов.
Вычислите концентрацию (моль/л) гидроксид-ионов в растворе, имеющем pH = 12,0.
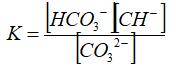
Скачать решение задачи 81 (методичка 120в) 90р
Задача №82.
Сущность процесса гидролиза сульфида калия выразите записью ионного уравнения.
K2S + H2O = KHS + KOH
Приведите выражение константы гидролиза по сульфид-иону.
Определите направление смещения равновесия гидролиза при уменьшении концентрации гидроксид-ионов.
Вычислите концентрацию (моль/л) ионов водорода в растворе, имеющем pH = 10,0.
Скачать решение задачи 82 (методичка 120в) 90р
Задача №83.
Сущность процесса гидролиза хлорида цинка выразите записью ионного уравнения.
ZnCl2 + H2O = ZnOHCl + HCl
Приведите выражение константы гидролиза по иону Zn (II).
Определите направление смещения равновесия гидролиза при увеличении в системе концентрации ионов водорода.
Вычислите концентрацию (моль/л) гидроксид-ионов в растворе со значением pH = 4,0.
Скачать решение задачи 83 (методичка 120в) 90р
Задача №84.
Сущность процесса гидролиза сульфата алюминия выразите записью ионного уравнения.
Al2(SO4)3 + H2O = 2AlOHSO4 + H2SO4
Приведите выражение константы гидролиза по иону Al (III).
Определите направление смещения равновесия гидролиза при уменьшении концентрации ионов водорода в растворе.
Вычислите концентрацию (моль/л) ионов водорода в растворе, имеющем pH = 9,0.
Скачать решение задачи 84 (методичка 120в) 90р
Задача №85.
Приведите выражение константы гидролиза по сульфат (IV)-иону:
SO32- + HOH = HSO3- + OH-
Определите направление смещения равновесия гидролиза по SO32- -иону при увеличении концентрации гидроксид-ионов в растворе.
Выразите гидролиз молекулярным уравнением
Укажите pH раствора с концентрацией гидроксид-ионов 1*10-9 моль/л.
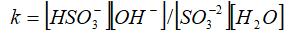
Скачать решение задачи 85 (методичка 120в) 90р
Задача №86.
Приведите выражение константы гидролиза по силикат-иону:
SiO32- + HOH = HSiO3- + OH-
Определите направление смещения равновесия гидролиза по SiO32- - иону при уменьшении в растворе концентрации гидроксид ионов.
Запишите уравнение гидролиза в молекулярной форме.
Укажите pH раствора с концентрацией гидроксид-ионов 1*10-9 моль/л.
Скачать решение задачи 86 (методичка 120в) 90р
Задача №87.
Приведите выражение константы гидролиза с участие ионов Ni (II):
Ni2+ + HOH = NiOH+ + H+
Определите направление смещения равновесия гидролиза по иону Ni (II) при увеличении в системе концентрации ионов водорода.
Выразите гидролиз молекулярным уравнением.
Какой из растворов является кислым, щелочным или нейтральным при концентрации (моль/л) ионов водорода: а) 1*10-7, б) 1*10-3 в) 1*10-8
Скачать решение задачи 87 (методичка 120в) 90р
Задача №88.
Уравнение
2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl
отражает процесс полного гидролиза (гидролиз по катиону и аниону).
Покажите сущность данной реакции записью ионного уравнения.
Возможно ли образование сульфида хрома (III) по обменной реакции в водном растворе?
Вычислите концентрации (моль/л.) ионов водорода и гидроксид - ионов в растворе, имеющем рН = 5,0.
Скачать решение задачи 88 (методичка 120в) 90р
Задача №89.
Составьте уравнение гидролиза сульфата меди (II). Покажите сущность процесса записью ионного уравнения.
Приведите выражение константы гидролиза по иону Cu (II).
Определите направление смещения равновесия гидролиза пол влиянием одноименных ионов.
Укажите pH раствора, имеющего концентрацию гидроксид-ионов 1*10-10моль/л.
Скачать решение задачи 89 (методичка 120в) 90р
Задача №90.
Составьте уравнение гидролиза нитрата свинца (II). Покажите сущность процесса записью ионного уравнения.
Приведите выражение константы гидролиза по иону Pb (II). Определите направление смещения равновесия гидролиза при разбавлении раствора.
Какой из растворов является кислым, если концентрация (моль/л) ионов водорода составляют: а) 1*10-3, б) 1*10-7 в) 1*10-11 ?
Скачать решение задачи 90 (методичка 120в) 90р
Решение задач 91-120 (методичка 120)
Задача №91.
Ион Fe (III) вступает в гидролитическое взаимодействие с водой в соответствие с уравнениями:
Fe3+ + HOH = FeOH2+ + H+ (первая ступень гидролиза)
FeOH2+ + HOH = Fe(OH)2+ + H+ (вторая ступень гидролиза)
При нагревании (длительном кипячении) возможна и третья ступень гидролиза. Составьте ионное уравнение третьей ступени гидролиза.
Приведите выражение константы одной из ступеней гидролиза.
Определите направление смещения равновесия гидролиза при увеличении в системе концентрации ионов водорода.
Выразите гидролиз молекулярными уравнениями.
Какой из растворов является щелочным, если концентрация (моль/л) ионов водорода составляет: а) 1*10-2, б) 1*10-7 в) 1*10-12?
Скачать решение задачи 91 (методичка 120в) 90р
Задача №92.
Гидролиз по ацетат-иону протекает в соответствии с уравнением:
CH3COO- + HOH = CH3COOH + OH-
Приведите выражение константы гидролиза по ацетат-иону. Рассчитайте константу гидролиза по ацетат-иону, используя ионное произведение воды (Kw) и значение константы ионизации (Ka) уксусной кислоты (KaCH3COOH = 1,74*10-5):
Kгидр = Kw/Ka
Выразите гидролиз по ацетат-иону молекулярным уравнением.
Какой из растворов является нейтральным, если концентрация (моль/л) ионов водорода составляет: а) 1*10-4, б) 1*10-7 в) 1*10-10?
Скачать решение задачи 92 (методичка 120в) 90р
Задача №93.
Гидролиз по фосфат-иону может протекает в соответствии с уравнением:
PO43- + HOH = HPO42- + OH- (первая ступень гидролиза)
HPO42- + HOH = H2PO4- + OH- (вторая ступень гидролиза)
Приведите выражение константы гидролиза по ступеням.
Назовите один из способов усиления гидролиза. Выразите гидролиз молекулярными уравнениями.
Укажите pH раствора с концентрацией гидроксид-ионов, равной 1*10-2 моль/л.
Скачать решение задачи 93 (методичка 120в) 90р
Задача №94.
Катион цинка (II) вступает в гидролитическое взаимодействие с водой в соответствии с уравнением:
Zn2+ + HOH = ZnOH+ + H+
Приведите выражение константы гидролиза по иону Zn (II).
Назовите способ ослабления гидролиза по данному иону. Выразите гидролиз молекулярным уравнением.
Укажите pH растворов с концентрацией ионов водорода, равной 1*10-12 моль/л.
Скачать решение задачи 94 (методичка 120в) 90р
Задача №95.
Гидролиз по фторид-иону и иодид-иону можно записать уравнениями:
F- + HOH = HF + OH-
I- + HOH = HI + OH-
Рассчитайте константы гидролиза, используя ионное произведение воды (Kw) и значение константы ионизации (Ka) кислот:
Kгидр = Kw/Ka
(KaHF = 6,2*10-4, KaHI = 1*10-11). По какому аниону гидролиз практически не протекает?
Запишите молекулярное уравнение гидролиза фторид-иона.
Вычислите концентрацию (моль/л) ионов водорода и гидроксид-ионов в растворе, имеющем pH = 10,0.
Скачать решение задачи 95 (методичка 120в) 90р
Задача №96.
Составьте уравнение гидролиза нитрата кобальта (II). Укажите характер среды раствора (кислая, нейтральная, щелочная). Покажите сущность гидролиза записью ионного уравнения.
Приведите выражение константы гидролиза по иону Co (II). Определите направление смещения равновесия гидролиза нитрата кобальта (II) при введении в раствор азотной кислоты.
Рассчитайте концентрацию (моль/л) гидроксид-ионов в растворе, имеющем pH = 12.
Скачать решение задачи 96 (методичка 120в) 90р
Задача №97.
Установите характер среды (кислая, нейтральная, щелочная) раствора сульфата никеля (II). Покажите сущность процесса гидролиза этого соединения записью ионного уравнения.
Определите направление смещения равновесия гидролиза сульфата никеля (II) при введении в раствор серной кислоты.
Рассчитайте концентрацию (моль/л) ионов водорода и гидроксид-ионов в растворе, имеющем pH = 10.
Скачать решение задачи 97 (методичка 120в) 90р
Задача №98.
Сущность процесса гидролиза нитрата марганца (II) выразите записью ионного уравнения.
Mn(NO3)2 + H2O = MnOHNO3 + HNO3
Приведите выражение константы гидролиза по иону Mn (II).
Определите направление смещения равновесия гидролиза при добавлении в раствор ионов водорода. Выразите гидролиз молекулярным уравнением.
Вычислите концентрацию (моль/л) гидроксид-ионов в растворе, имеющем pH = 3,0.
Скачать решение задачи 98 (методичка 120в) 90р
Задача №99.
Гидролиз по фторид-иону и цианид-иону может протекать в соответствии с уравнением:
F- + HOH = HF + OH-
CN- + HOH = HCN + OH-
Рассчитайте значения констант гидролиза, используя ионное произведение воды (Kw) и значение констант ионизации (Ka) кислот:
Kгидр = Kw/Ka
(KaHF = 6,62*10-4, KaNCN = 5*10-10).
По какому аниону гидролиз протекает в большей степени? Выразите гидролиз по фторид- и цианид – ионам молекулярными уравнениями. Каким образом можно усилить гидролиз? Вычислите концентрации (моль/л) ионов водорода и гидроксид-ионов в растворе, имеющем pH = 4,0.
Скачать решение задачи 99 (методичка 120в) 90р
Задача №100.
Установите характер среды (кислая, нейтральная, щелочная) растворов иодида калия и цианида калия. Ответ подтвердите уравнениями гидролиза. Покажите сущность процесса гидролиза KCN записью ионного уравнения. Приведите выражение константа гидролиза по цианид - иону. Назовите способы усиления гидролиза.
Вычислите концентрацию (моль/л) гидроксид - ионов в растворе, имеющем рН = 5,0.
Скачать решение задачи 100 (методичка 120в) 90р
Задача №101.
Необходимо составить уравнения реакций, учитывая изменения степеней окисления элементов.
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
J2 + 5Cl2 + 6H2O = 2HJO3+ 10HCl
Скачать решение задачи 101 (методичка 120в) 90р
Задача №102.
Составить уравнение реакций, учитывая степени окисления элементов
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + Na2SO4 + H2O
Скачать решение задачи 102 (методичка 120в) 90р
Задача №103.
Составить уравнение реакций, учитывая степени окисления элементов
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
3Zn + H3AsO3 + 6HCl = 3ZnCl2 + H3As + 3H2O
Скачать решение задачи 103 (методичка 120в) 90р
Задача №104.
Составить уравнение реакций, учитывая степени окисления элементов
5Co + 12HNO3 = 5Co(NO3)2 + N2 + 6H2O
6FeSO4 + 3H2SO4 + KClO3 = 3Fe2(SO4)3 + KCl + 3H2O
Скачать решение задачи 104 (методичка 120в) 90р
Задача №105.
Составить уравнение реакций, учитывая степени окисления элементов
2Fe + 6HNO3 = Fe2O3 + 6NO2 + 3H2O
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Скачать решение задачи 105 (методичка 120в) 90р
Задача №106.
Составить уравнение реакций, учитывая степени окисления элементов
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
2KMnO4 + 2H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH + H2O
Скачать решение задачи 106 (методичка 120в) 90р
Задача №107.
Составить уравнение реакций, учитывая степени окисления элементов
Zn + 2H2O + 2KOH = NO2[Zn(OH)4] + H2
4NH3 + 5O2 = 4NO + 6H2O
Скачать решение задачи 107 (методичка 120в) 90р
Задача №108.
Составить уравнение реакций, учитывая изменения степеней окисления элементов:
Cu + H2SO4 = CuSO4 + SO2 + H2O
K2Cr2O7 + H2SO4 + H2S = Cr2(SO4)3 + S + K2SO4 + H2O
Скачать решение задачи 108 (методичка 120в) 90р
Задача №109.
Составить уравнение реакций, учитывая степени окисления элементов
3Ta + 5HNO3 + 21HF = 3H2(TaF7) + 5NO + 10H2O
2KMnO4 + 8H2SO4 + 10KJ = 2MnSO4 + 5J2 + 6K2SO4 + 8H2O
Скачать решение задачи 109 (методичка 120в) 90р
Задача №110.
Составить уравнение реакций, учитывая изменения степеней окисления:
Ag + HNO3 = AgNO3 + NO + H2O
NaOCl + H2SO4 + KJ = NaCl + J2 + K2SO4 + H2O
Скачать решение задачи 110 (методичка 120в) 90р
Задача №111.
Составить уравнение реакций, учитывая степени окисления элементов:
Al + H2O + KOH = K2[Al(OH)6] + H2
K2Cr2O7 + HCl = CrCl3 + Cl2 + KCl + H2O
Скачать решение задачи 111 (методичка 120в) 90р
Задача №112.
Составить уравнение реакций, учитывая степени окисления элементов
W+2HNO3 + 8HF = H2(WF8) + 2NO + 4H2O
3KNO3 + 2KOH + Fe = 3KNO2 + K2FeO4 + H2O
Скачать решение задачи 112 (методичка 120в) 90р
Задача №113.
Составить уравнение реакций, учитывая степени окисления элементов
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O
Di(OH)3 + Cl2 + 3NaOH = NaBiO3 + 2NaCl + 3H2O
Скачать решение задачи 113 (методичка 120в) 90р
Задача №114.
Составить уравнение реакций, учитывая степени окисления элементов
Na + H2O = NaOH + H2
Cr2(SO4)3 + Br2 + NaOH = Na2CrO4 + NaBr + Na2SO4 + H2O
Скачать решение задачи 114 (методичка 120в) 90р
Задача №115.
Составить уравнение реакций, учитывая степени окисления элементов.
Al + HNO3 = Al2O3 + NO2 + H2O
MnSO4 + KOH + KClO3 = K2MnO4 + KCl + K2SO4 + H2O
Скачать решение задачи 115 (методичка 120в) 90р
Задача №116.
Составить уравнение реакций, учитывая степени окисления элементов
KMnO4 + HCl = Cl2 + MnCl2 + KCl + H2O
Zn + H2SO4 = ZnSO4 + S + H2O
Скачать решение задачи 116 (методичка 120в) 90р
Задача №117.
Составить уравнение реакций, учитывая изменения степеней окисления элементов:
Cr + KNO3 + KOH = K2CrO4 + KNO2 + H2O
Cl2 + NaOH = NaCl + NaClO3 + H2O
Скачать решение задачи 117 (методичка 120в) 90р
Задача №118.
Составить уравнение реакций, учитывая степени окисления элементов
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
8KMnO4 + 12H2SO4 + 5H3P = 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
Скачать решение задачи 118 (методичка 120в) 90р
Задача №119.
Составить уравнение реакций, учитывая степени окисления элементов
Sn + 2H2O + 2KOH = K2[Sn(OH)4] + H2
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
Скачать решение задачи 119 (методичка 120в) 90р
Задача №120.
Составить уравнение реакций, учитывая степени окисления элементов
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
2KBr + 4HNO3 + PbO2 = Br2 + Pb(NO3)2 + 2KNO3 + 2H2O
Скачать решение задачи 120 (методичка 120в) 90р


